
下列关于物质的量浓度表述正确的是( )
A.0.3 mol·L-1的Na2SO4溶液中含有Na+和 的总物质的量为0.9 mol
的总物质的量为0.9 mol
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和 的物质的量相等,则K+和Cl-的物质的量浓度一定相同
的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D.10 ℃时,100 mL 0.35 mol·L-1的KCl饱和溶液蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1
D
【解析】
试题分析:A、溶液中含有Na+和SO42?总物质的量与溶液体积有关,溶液的体积未知,离子的物质的量不一定,故A错误;B、氨气所处的状态未定,不一定是标准状况,氨气的物质的量不一定是1mol,所得氨水的浓度不一定是1 mol?L-1,故B错误;C、在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42?的物质的量相等,根据电荷守恒,K+的物质的量浓度一定大于Cl-的物质的量浓度,故C错误;D、10℃KCl饱和溶液100 mL,蒸发掉5g水,再冷却到10℃时,溶液仍是饱和溶液,温度相同溶解度相同,溶液的浓度相同,物质的量浓度仍为0.35 mol/L,故D正确。
考点:本题考查物质的量浓度、溶解度。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
通过复习总结,下列归纳正确的是
A.酸酐一定是酸性氧化物
B.Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物
C.简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性
D.一种元素可能有多种氧化物,但同种化合价只对应有一种氧化物
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
能源材料是当今科学研究的热点。氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见下图)可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是

A.C60、Si60、N60都属于新型化合物
B.C60、Si60、N60互为同分异构体
C.已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
D.已知金刚石中C-C键长154pm,C60中C-C键长145 ~140pm,故C60熔点高于金刚石
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:填空题
(10分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现取三份100mL溶液进行如下实验:
①第一份溶液加入硝酸银溶液有沉淀生成
②第二份加入过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲。
③在第二份所得的甲溶液中通入过量的CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g。
④第三份溶液加入足量BaCl2溶液后,得到白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g。
根据上述实验回答:
(1)一定不存在的离子是 。
(2)试确定一定存在的阴离子及其浓度(可不填满)
离子符号 ,浓度 。
离子符号 ,浓度 。
(3)试确定K+是否存在 (填“是”或“否”)理由是: 。
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:选择题
在下列各溶液中离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、 Cl-、SO42-
B.含0.1mol/L Fe3+的溶液中:K+ 、Mg2+ 、I-、NO3-
C.含0.1mol/L Ca2+的溶液中:Na+、K+ 、CO32- 、Cl-
D.室温下pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:选择题
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为x。则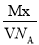 表示的是( )
表示的是( )
A.V L该气体的质量(以g为单位)
B.1 L该气体的质量(以g为单位)
C.1 mol该气体的体积(以L为单位)
D.1 L该气体中所含的分子数
查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:填空题
(14分) 一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的离子反应方程式为(产物中只有一种酸根) 。请从反应原理分析不用盐酸酸化的主要原因____________________________________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用:__________________________________;____________________________。
(4)某天然碱的化学式可表示为2Na2CO3·NaHCO3·2H2O,取少量该物质溶于水得稀溶液P。下列有关溶液P中微粒的物质的量浓度关系正确的是______(填序号)。
A.c(CO32-) > c(HCO3-)> c(OH-)> c(H+)
B.c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
C.3c(Na+)>5c(CO32-)+5c(HCO3-)
D.将P溶液与少量NaOH溶液混合:c(Na+)+ c(H+)= c(HCO3-)+ 2c(CO32-)+ c(OH-)
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是_______________。

查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:填空题
有难溶于水的粉末状固体样品,可能含有Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种,研究小组通过实验确定样品的成分.
【查阅资料知】① Cu2O + 2H+ = Cu + Cu2+ + H2O;
② 部分氢氧化物在溶液中沉淀的pH见下表:
物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 1.8 | 6.3 | 5.2 |
完全沉淀的pH | 3.0 | 8.3 | 6.7 |
【注】金属离子的起始浓度为0.1 mol·L-1
【实验步骤】
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀.
请回答下列问题.
(1)Ⅰ中产生气体的离子方程式为 .
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 .
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是 .
(4)Ⅳ中加NaClO的目的是 .
(5)将Ⅳ中得到的溶液D电解,阳极的电极反应式为 ;若电路中有0.1mol电子通过,则理论上阴极质量增重 g.
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合为
(用化学式表示).
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三9月第二次阶段考化学试卷(解析版) 题型:选择题
下列情况不能用胶体知识加以解释的是 ( )
A.氯化铝溶液中加入小苏打溶液会产生白色沉淀和无色气体
B.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
C.水泥厂、冶金厂常用高压电除工厂烟尘,以减少对空气的污染
D.牛油与烧碱溶液共热,向反应所得溶液中加入食盐,则有固体析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com