
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ϴ������ƿ������ƿ���ԷŽ������к�� |
| B��������ƿ������Һʱ������ˮ�����̶��ߣ������õι����������Һ�� |
| C����������ʱ���ʯ���� |
| D���÷�Һ©����Һʱ���ϲ�Һ��Ӧ���Ͽڵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
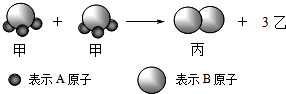 ��ͼ��ʾ2�����ӷ�Ӧ����1�������Ӻ�3���ҷ��ӣ������жϲ���ȷ���ǣ�������
��ͼ��ʾ2�����ӷ�Ӧ����1�������Ӻ�3���ҷ��ӣ������жϲ���ȷ���ǣ�������| A��1���ҷ����к���2��Aԭ�� |
| B���÷�Ӧ�����ǷֽⷴӦ |
| C���÷�Ӧһ������������ԭ��Ӧ |
| D��Ħ��������ϵΪ��2M ���ף�=M ���ң�+M ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
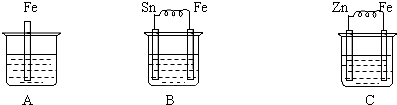
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��2Al2O3�����ڣ�
| ||||
B��Fe2O3+3CO
| ||||
| C��Fe+CuSO4�TFeSO4+Cu | ||||
D��AL+3MgO
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������ȼ�� |
| B��п��ϡ���ᷴӦ��ȡ���� |
| C��������������Ƶ��кͷ�Ӧ |
| D����̿�ڸ�������ˮ������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������������������Fe��OH��3+3H+=Fe3++3H2O |
| B��NaHCO3��Һ�м��������Ba��OH��2��Һ��2HCO3-+Ba2++2OH-=BaCO3��+2H2O+CO32- |
| C��NH4Al��SO4��2��Һ�м���Ba��OH��2��ҺʹSO42-��ȫ������Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4��+2H2O |
| D������0.4 mol FeBr2����Һ��ͨ��0.1 mol Cl2��Ӧ��2Fe2++Cl2=2Fe3++2Cl- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com