
| A. | 基态时,相同周期的两种元素原子所含的能级和能层是一样的 | |
| B. | 基态时,稀有气体元素原子的价层电子数都为8 | |
| C. | 基态时,同种元素的原子和离子的轨道排布式一样 | |
| D. | 非金属元素原子的d轨道一定不填充电子或填满电子 |
分析 A、基态时,相同周期的两种元素原子所含的能层是一样的,但能级不一定相同;
B、稀有气体氦价电子数为2;
C、同种元素的原子和离子核外电子数不同,所以轨道排布式不一样;
D、非金属元素位于s区和p区,位于s区d轨道不填充电子,而位于p区d轨道填满电子.
解答 解:A、基态时,相同周期的两种元素原子所含的能层是一样的,但能级不一定相同,如第四周期的钙与过渡元素能级不同,过渡元素出现了d能级,故A错误;
B、稀有气体氦价电子数为2,而不是8,故B错误;
C、同种元素的原子和离子核外电子数不同,所以轨道排布式不一样,故C错误;
D、非金属元素位于s区和p区,位于s区d轨道不填充电子,而位于p区d轨道填满电子,故D正确;
故选D.
点评 本题考查结构与位置关系、元素周期表,难度不大,注意把握元素周期表的结构,基态时原子和离子核外电子数不同所以轨道排布不同.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| B. | NaHCO3溶液中加入过量的 Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 氯化铝溶液中加入过量氨水 Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)═c(HCO3-)+c(CO32-) | |
| B. | 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)>c(Cl-) | |
| C. | 向浓度为0.1mol/LNaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH<13 | |
| D. | 将0.1molAgCl投入到100mL0.1mol/LNaCl溶液中:c(Ag+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
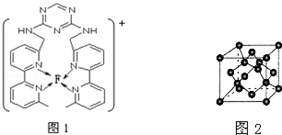
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
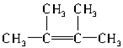 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
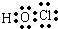 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 吸热反应不加热就不会发生 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com