
 氯及其化合物在生活和生产中应用广泛.
氯及其化合物在生活和生产中应用广泛.分析 (1)①反应自发进行的判断依据是△H-T△S<0;
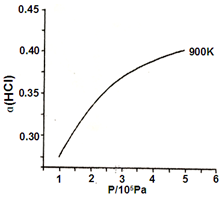
②900K时,体积比为4:1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(P)变化曲线如图.保持其他条件不变,升温到T K,平衡逆向进行,HCl转化率减小,随压强增大平衡正向进行,HCl转化率增大,据此画出;
(2)①Ⅰ.Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△Hl=-102kJ•mol-1
Ⅱ.3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△H2=-422kJ•mol-1
盖斯定律计算Ⅱ-Ⅰ×3得到NaClO分解生成NaClO3的热化学方程式;
②氯气和氢氧化钠生成氯离子,次氯酸钠分解生成氯离子,溶液中氯离子为二者总和;
③常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,说明反应进行决定于反应Ⅰ,反应Ⅰ活化能大难于进行;
(3)电解NaClO3水溶液可制备NaClO4.在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降.为抑制氢气的产生,可选择合适的物质氧气和氢气反应生成水;
解答 解:(1)①900 Κ时,4HCl(g)+O2?2Cl2(g)+2H2O(g),△S<0,反应自发满足△H-T△S<0,△H<0,故答案为:放热,△S<0,反应自发满足△H-T△S<0;
②900K时,体积比为4:1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(P)变化曲线如图.保持其他条件不变,升温到T K,平衡逆向进行,HCl转化率减小,随压强增大平衡正向进行,HCl转化率增大,据此画出图象为: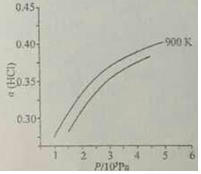 ,
,
故答案为: ;
;
(2)①Ⅰ.Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△Hl=-102kJ•mol-1
Ⅱ.3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△H2=-422kJ•mol-1
盖斯定律计算Ⅱ-Ⅰ×3得到NaClO分解生成NaClO3的热化学方程式:
3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol,
故答案为:3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol;
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol•L-1,则Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)反应中生成氯离子浓度为c0 mol•L-1,加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为c1 mol•L-1,反应的次氯酸钠浓度=c0 mol•L-1-c1 mol•L-1
3NaClO(aq)=2NaCl(aq)+NaClO3(aq)
3 2 1
c0 mol•L-1-c1 mol•L-1 $\frac{2}{3}$×(c0 mol•L-1-c1 mol•L-1)
该时刻溶液中Cl-浓度的表达式:c0 mol•L-1+$\frac{2}{3}$×(c0 mol•L-1-c1 mol•L-1 )=$\frac{5{c}_{0}-2{c}_{1}}{3}$,
故答案为:$\frac{5{c}_{0}-2{c}_{1}}{3}$;
③③常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,说明反应进行决定于反应Ⅰ,反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化,
故答案为:反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化;
(3)电解NaClO3水溶液可制备NaClO4.在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降.为抑制氢气的产生,可选择合适的物质氧气和氢气反应生成水,该电解池中电解的化学方程式为:2NaClO3+O2$\frac{\underline{\;通电\;}}{\;}$2NaClO4,
故答案为:2NaClO3+O2$\frac{\underline{\;通电\;}}{\;}$2NaClO4;
点评 本题考查了反应自发进行的判断依据、热化学方程式书写、反应过程中微粒浓度计算、电解化学方程式书写等,注意知识积累和题干信息的分析,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)
实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正丁烷的结构简式:C4H10 | |
| B. | S2-的结构示意图: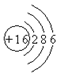 | |
| C. | NH3的电子式: | |
| D. | 碳酸钠电离方程式:Na2CO3=Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 溶液从烧杯转移到容量瓶后没有洗涤烧杯 | |
| C. | 未冷却即将溶液转移到容量瓶 | |
| D. | 加水未达到容量瓶刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属,化合物 | B. | 金属氧化物,碱性氧化物 | ||
| C. | 泥沙,胶体 | D. | 单质,纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| C. | 氯原子数为0.2NA的氯气溶于水转移的电子数0.1NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com