
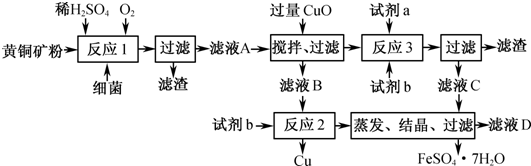
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验

将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
① 阳极区硫酸铁的主要作用是 。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。
(16分)
(1)①吸收硫化氢气体,防止环境污染(1分)
②Fe2+- e-→Fe3+(1分)
(2)2H++2 e-→H2↑ Cu2++2e-→Cu 2Cu+O2+2H2SO4=2CuSO4+2H2O(各1分)
(3)分液漏斗 (1分)
富集Cu2+,分离Cu2+与其它金属阳离子 (2分,每个要点1分)
(4)增大H+浓度,使平衡2RH(有机相) + Cu2+(水相)  R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生(1分)
R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生(1分)
(5) c(H+)>c(SO42-)>c(Cu2+)>c(OH-)(2分)
【解析】
试题分析:
(1)根据反应:CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+①可知硫酸铁作用为吸收硫化氢气体,防止环境污染;②吸收硫化氢气体要消耗Fe3+ ,而其浓度不变必须Fe2+在阳极放电:Fe2+- e-→Fe3+。
(2)根据题中现象和离子放电规律可知:2H++2 e-→H2↑
Cu2++2e-→Cu 2Cu+O2+2H2SO4=2CuSO4+2H2O(各1分)
(3)分离互不相容的液体要使用分液漏斗 ;
萃取的作用在于富集Cu2+,分离Cu2+与其它金属阳离子。
(4)根据题意可知:增大H+浓度,使平衡2RH(有机相) + Cu2+(水相)  R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生。
R2Cu(有机相)+ 2H+(水相)逆向移动,Cu2+进入水相得以再生。
(5)电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g时,相当于等浓度的CuSO4和硫酸的混合液,其中Cu2+部分水解,得c(H+)>c(SO2- 4)>c(Cu2+)>c(OH-)。
考点:考查元素及其化合物、电化学、化学实验、离子浓度判断等相关知识。


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:查看答案和解析>>
科目:高中化学 来源:高一化学(通用各科奥林匹克ABC卷及解析) 题型:043
用黄铜矿炼铜按反应物和生成物可将总反应写成:
事实上冶炼反应是分步进行的.①黄铜矿在氧气作用下生成硫化亚铜和硫化亚铁;②硫化亚铁在氧气作用下生成氧化亚铁,并与二氧化硅反应生成矿渣;③硫化亚铜与氧气反应生成氧化亚铜;④硫化亚铜与氧化亚铜反应生成铜.
(1)写出上述各个分步反应的化学方程式
①________________________________________________________;
②________________________________________________________;
③________________________________________________________;
④________________________________________________________.
(2)总反应的化学方程式中各物质的系数依次为_____________.
(3)据最新报道,有一种叫Thibacillus ferroxidans的细菌在氧气存在下可以将黄铜矿氧化成硫酸盐.反应是在酸性溶液中发生的.试写出配平的化学方程式:________________.
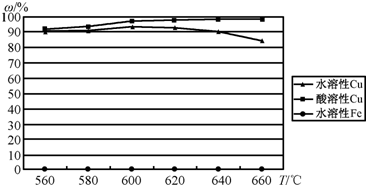
(4)最近我国学者发现,以精![]() 矿为原料在沸腾炉中和
矿为原料在沸腾炉中和![]() (空气)反应,生成物冷却后经溶解、除铁、结晶,得到
(空气)反应,生成物冷却后经溶解、除铁、结晶,得到![]() ,成本降低了许多.实验结果如下:
,成本降低了许多.实验结果如下:

回答如下问题:
①![]() 和
和![]() 主要反应的化学方程式为:________________;
主要反应的化学方程式为:________________;
②实际生产过程的沸腾炉温度为600℃~620℃.控制反应温度的方法是:________.
③温度高于600℃~620℃生成物中水溶性Cu(%)下降的原因是:________.
查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com