
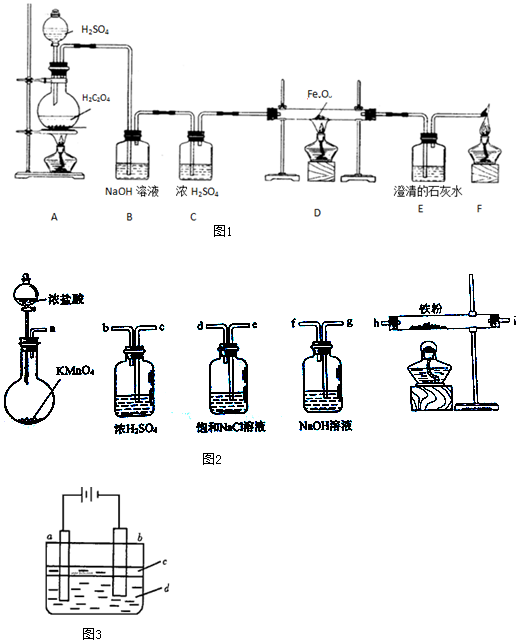
分析 实验一:(1)草酸晶体(H2C2O4)在浓硫酸条件下加热分解:H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+H2O,为了制取干燥纯净的CO气体,并用生成的CO气体还原FexOy,制取铁粉,所以装置B氢氧化钠为吸收生成的二氧化碳气体,装置C浓硫酸为干燥CO,E澄清石灰水为检验CO还原FexOy生成的产物二氧化碳气体,最后点燃除去多余的CO,防止污染空气,据此分析;
(2)依据C守恒关系可得:CO~CO2~CaCO3,FexOy中氧的质量为:m(CO2)-m(CO),根据碳酸钙的量可计算出该氧化物中氧元素的物质的量、质量,然后根据该氧化物的质量计算出铁元素的质量,最后计算出铁元素与氧元素的物质的量之比即可;
实验二:实验室制备无水氯化铁,需要先制取纯净、干燥的氯气,用a装置制备氯气,制取出的氯气中有HCl和水蒸气,应先用饱和食盐水洗气除去HCl,选用ed,由于无水氯化铁遇潮湿空气极易吸水生成FeCl3•nH2O,cb用于干燥氯气,制取了纯净干燥的氯气后,通入铁粉,在加热条件下与铁粉反应,氯气是污染性气体,连接尾气处理装置吸收未反应的氯气,防止污染空气,根据实验原理和目的及各装置的作用决定仪器排列组装顺序;
实验三:①制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极;
②苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化.
解答 解:实验一:(1)草酸晶体(H2C2O4)在浓硫酸条件下加热分解:H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+H2O,为了制取干燥纯净的CO气体,并用生成的CO气体还原FexOy,制取铁粉,所以装置B氢氧化钠为吸收生成的二氧化碳气体,装置C浓硫酸为干燥CO,E澄清石灰水为检验CO还原FexOy生成的产物二氧化碳气体,则看到的现象为澄清石灰水变浑浊,最后F处点燃除去多余的CO,防止污染空气,故答案为:吸收制备CO时产生的CO2;澄清石灰水变浑浊;除CO防止污染空气;
(2)依据C守恒关系可得:CO~CO2~CaCO3,0.75g白色沉淀为碳酸钙,则:n(CaCO3)=n(CO)=$\frac{0.75g}{100g/mol}$=7.5×10-3mol,
则FexOy中氧元素的质量为:m(CO2)-m(CO)=44 g•mol-1×7.5×10-3mol-28 g•mol-1×7.5×10-3mol=0.12g,
0.4g FexOy中铁元素的物质的量为:n(Fe)=$\frac{0.4g-0.12g}{56g/mol}$=0.005mol,
0.4g FexOy中氧元素的物质的量为:n(O)=$\frac{0.12g}{16g/mol}$=0.0075 mol,
则:$\frac{x}{y}$=$\frac{0.005mol}{0.0075mol}$=$\frac{2}{3}$,所以FexOy的化学式为Fe2O3,
故答案为:Fe2O3;
实验二:实验室制备无水氯化铁,需要先制取纯净、干燥的氯气,用a装置制备氯气,故最先使用的仪器是a;
浓盐酸有挥发性,所以氯气中含有氯化氢气体,制取出的氯气中有HCl和水蒸气,氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和食盐水除去氯气中混有的氯化氢气体,而洗气时,气体要长进短出,故接下来的气流的方向是e→d;
然后用浓硫酸干燥氯气,故接下来的气流的方向是c→b;
制取了纯净干燥的氯气后,通入铁粉,在加热条件下与铁粉反应,故接下来连h;
氯气是污染性气体,对空气有污染,故应连接尾气处理装置,考虑到氯气是酸性气体,故要用碱液来吸收,故接下来通入NaOH 溶液,气流的方向是i→g;故仪器连接顺序正确的是a-e-d-c-b-h-i-g,故答案为:a-e-d-c-b-h-i-g;
实验三:①制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极,a电极反应式为Fe-2e-=Fe2+,故答案为:Fe;Fe-2e-=Fe2+;
②苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对c溶液进行加热煮沸的目的是排出溶液中的氧气,故答案为:隔绝空气防止氢氧化亚铁被氧化.
点评 本题考查了制备实验方案设计评价以及电解原理,侧重考查装置的作用、仪器的连接顺序的问题以及计算等,重点是掌握制备原理及离子放电顺序是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O=H2CO3 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO | ||
| C. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | D. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Cl-、Fe2+、K+ | D. | NO3-、AlO2-、OH-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若三种溶液中c(H+)分别为a1 mol•L-1、a2 mol•L-1、a3 mol•L-1,则它们的大小关系为$\frac{1}{2}$a2=a1=a3 | |
| B. | 等体积的以上三种酸分别与过量的NaOH溶液反应,若生成的盐的物质的量依次为b1 mol、b2 mol、b3 mol,则它们的大小关系为b1=b2<b3 | |
| C. | 分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为V1=V2=V3 | |
| D. | 分别与Zn反应,开始时生成H2的速率分别为v1、v2、v3,其大小关系为v2>v1>v3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)+c(H+)=c(OH-)+2c(S2-)+c(HS-) | B. | c(OH-)=c(HS-)+c(H+)+2c(H2S) | ||
| C. | c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | D. | c(OH-)=c(HS-)+c(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL2mol/LMgCl2溶液 | B. | 200mL2mol/LNaCl溶液 | ||
| C. | 250mL1mol/LAlCl3溶液 | D. | 100mL2mol/LKClO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com