
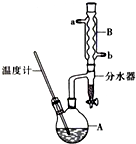
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:| 相对分子质量 | 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.分析 (1)根据浓硫酸的稀释操作,进行迁移解答;正丁醇在浓硫酸、加热135℃条件下发生分子间脱水反应生成CH3CH2CH2CH2OCH2CH2CH2CH3;
(2)采取逆流原理通入冷凝水进行充分冷却;
(3)用水可以溶解浓硫酸;正丁醇、正丁醚不溶于水,溶液分层,粗产品的密度小于水在上层;
(4)有机层中会残留NaOH及中和反应生成的盐Na2SO4,用水溶解除去;
(5)正丁醚沸点为142℃,粗产品中含有正丁醇,其沸点为117.2℃,低于正丁醚的沸点,加热蒸馏正丁醇先汽化;
(6)反应控制温度135℃,高于正丁醇的沸点,正丁醇、水均挥发,从球形冷凝管中冷凝回流的为正丁醇、水,正丁醇微溶于水,在分水器中会分层,密度小的在上层;
(7)根据正丁醇的质量计算正丁醚的理论产量,样品产率=(实际产量÷理论产量)×100%.
解答 解:(1)因为浓硫酸的密度大,应将浓硫酸加到正丁醇中,防止发生迸溅,所以正确的操作方法为:先加正丁醇,再加浓H2SO4或将浓H2SO4滴加到正丁醇中;
正丁醇在浓硫酸、加热135℃条件下发生分子间脱水反应生成CH3CH2CH2CH2OCH2CH2CH2CH3,反应方程式为:2CH3CH2CH2CH2OH  CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,
故答案为:先加正丁醇,再加浓H2SO4或将浓H2SO4滴加到正丁醇中;2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O;
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O;
(2)采取逆流原理通入冷凝水,使冷凝管充分冷凝水,进行充分冷却,即从b口通入冷凝水,
故答案为:b;
(3)用水可以洗去混有的浓H2SO4;正丁醇、正丁醚不溶于水,溶液分层,粗产品的密度小于水在上层,应从分液漏斗的上口分离出,
故答案为:浓H2SO4;上;
(4)步骤④中最后一次水洗,可以洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4,
故答案为:洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4;
(5)正丁醚沸点为142℃,粗产品中含有正丁醇,其沸点为117.2℃,低于正丁醚的沸点,加热蒸馏正丁醇先汽化,加热蒸馏时应收集142℃左右的馏分,
故答案为:d;
(6)反应控制温度135℃,高于正丁醇的沸点,正丁醇、水均挥发,从球形冷凝管中冷凝回流的为正丁醇、水,正丁醇微溶于水,密度小于水,在分水器中会分层,正丁醇在上层,水在下层,
故答案为:正丁醇;水;
(7)由2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,可知37g正丁醇完全反应得到正丁醚的质量为:$\frac{37g}{74g/mol}$×$\frac{1}{2}$×130g/mol=32.5g,
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,可知37g正丁醇完全反应得到正丁醚的质量为:$\frac{37g}{74g/mol}$×$\frac{1}{2}$×130g/mol=32.5g,
所以样品产率为:$\frac{11g}{32.5g}$×100%=33.85%,
故答案为:33.85%.
点评 本题考查有机物的制备实验,题目难度中等,侧重考查物质分离提纯、对原理与操作的分析评价、产率计算等知识,明确实验目的及制备原理为解答关键,试题培养了学生的分析能力及化学实验能力.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
| 物质 | C | CO | C2H6 | C2H5OH |
| 燃烧热/KJ•mol-1 | 393.5 | 283 | 1559.8 | 1366.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烷 | B. | 乙烷 | C. | 丙烯 | D. | 甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 把t2℃时的MgSO4饱和溶液的温度升高,溶液仍然饱和 | |
| B. | 将t3℃时的MgSO4饱和溶液的温度降低,有晶体析出 | |
| C. | t2℃时,饱和溶液的溶质物质的量浓度:MgSO4比NaCl大 | |
| D. | 分别将t1℃时MgSO4饱和溶液、NaCl饱和溶液的温度升高到t2℃,所得溶液的溶质质量分数前者更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{r(Ca)}{r(Mg)}$ | B. | $\frac{r(C{l}^{-})}{r(A{l}^{3+})}$ | C. | $\frac{r(Na)}{r(Mg)}$ | D. | $\frac{r(N{a}^{+})}{r({F}^{-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
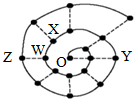 某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )| A. | 物质YO可能具有较强的氧化性 | |
| B. | 图中离O点越远的元素,其原子半径一定越大 | |
| C. | O2X、WO3分子内都含有氢键,所以沸点都较高 | |
| D. | 科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的Z元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠保存在煤油中 | |
| B. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| C. | 合金的硬度一般比各成分金属大 | |
| D. | 铜与氯化铁溶液的反应常用于制作印刷电路板 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com