
����Ŀ����֪����������������������м��㷺��;��
��1����֪��Ӧ����2NH3��g��+CO2��g���TNH2CO2NH4��s����H=��159.5kJ/mol
��Ӧ����NH2CO2NH4��s���TCO��NH2��2 ��s��+H2O��g����H= + 116.5kJ/mol
��Ӧ����H2O��l���TH2O��g����H= + 44.0kJ/mol
��ҵ����CO2��NH3Ϊԭ�Ϻϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽΪ___________________���÷�Ӧ��_________�����¿����Է����У��������������������������κ��¶���������
��2���������Ͽ�֪�������£�K��[Ag��NH3��2+]=1.00��107��Ksp[AgCl]=2.50��10��10��
��������Һ�д���ƽ�⣺Ag+��aq��+2NH3��aq��![]() Ag��NH3��2+ ��aq�����÷�Ӧƽ�ⳣ���ı���ʽΪK��=_______________��
Ag��NH3��2+ ��aq�����÷�Ӧƽ�ⳣ���ı���ʽΪK��=_______________��
�ڼ���õ����淴ӦAgCl ��s��+2NH3��aq��![]() Ag��NH3��2+ ��aq��+Cl����aq���Ļ�ѧƽ�ⳣ��K=_________________________����1LŨ��Ϊ1mol/L��ˮ���������ܽ�AgClΪ_______mol������2λ��Ч���֣���
Ag��NH3��2+ ��aq��+Cl����aq���Ļ�ѧƽ�ⳣ��K=_________________________����1LŨ��Ϊ1mol/L��ˮ���������ܽ�AgClΪ_______mol������2λ��Ч���֣���
���𰸡� 2NH3��g��+CO2��g��=CO(NH2)2 (s) +H2O��l�� ��H=��87 kJ/mol ���� K= 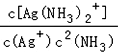 2.5��10��3 0.045
2.5��10��3 0.045
����������1����Ӧ������Ӧ������Ӧ���õ���2NH3��g��+CO2��g��=CO(NH2)2 (s) +H2O��l�� ��H=��87 kJ/mol���Է���Ӧ��Ҫ���ǣ���G=��H��T��s��0���÷�Ӧ������ת��Ϊ��Һ��������������s��0����Ӧ����H��0��������Ϊ��ʹ��GС��0�����¶�TԽ��Խ���������÷�Ӧ�ڵ������Է���
��2������ӦΪ��Ag+��aq��+2NH3��aq��![]() Ag��NH3��2+ ��aq��������ƽ�ⳣ������ʽΪK��=
Ag��NH3��2+ ��aq��������ƽ�ⳣ������ʽΪK��=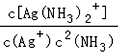 ��
��
��AgCl ��s��+2NH3��aq��![]() Ag��NH3��2+ ��aq��+Cl����aq���Ļ�ѧƽ�ⳣ��
Ag��NH3��2+ ��aq��+Cl����aq���Ļ�ѧƽ�ⳣ��
![]()
�� 1LŨ��Ϊ1mol/L��ˮ�к���1molNH3�������ܽ�Xmol��AgCl��
AgCl ��s��+ 2NH3��aq�� ![]() Ag��NH3��2+ ��aq�� + Cl����aq��
Ag��NH3��2+ ��aq�� + Cl����aq��
��ʼ�� 1 0 0
�ܽ⣺ X 2X X X
ƽ�⣺ 1-2X X X
���ԣ� 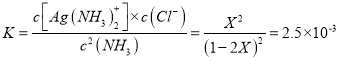 �����X=0.045��
�����X=0.045��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʣ��ٰ��ס��ڽ��ʯ����ʯī���ܶ�������ݼ��顡�����Ȼ�̼����笠����ӣ�����ӽṹ����ṹ��Ԫ�д��������������(����)
A. �٢ڢܢݢޢ� B. �٢ڢݢ� C. �ڢ� D. �ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ���о�pH��һ��Ũ��FeSO4���ȶ��Ե�Ӱ�죬������ͼ��������������
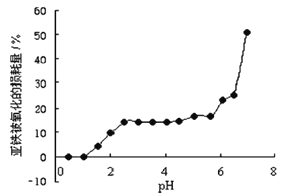
A. pHС��1ʱ��������������ģ����ܵ�ԭ����4Fe2++ O2+ 10H2O![]() 4Fe(OH)3 + 8H+ƽ�������ƶ�
4Fe(OH)3 + 8H+ƽ�������ƶ�
B. pH��3.0~5.5֮�䣬pH�ı仯��FeSO4�ȶ���Ӱ�첻��
C. pH����6.5ʱ�����������ͻ�䣬���ܵ�ԭ�������ɵ�Fe(OH) 2���ױ�����
D. ����������ͬʱ��FeSO4��Һ�м�������(NH4)2SO4���壬FeSO4���ȶ��Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���о�Na2S��Һ��KMnO4��Һ��Ӧ��̽���������¡�
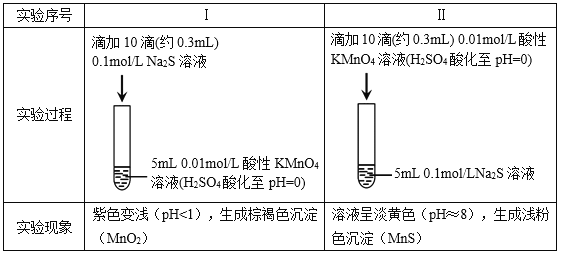
���ϣ���. ![]() ��ǿ���������±���ԭΪMn2+���ڽ����������±���ԭΪMnO2��
��ǿ���������±���ԭΪMn2+���ڽ����������±���ԭΪMnO2��
��. �����������������Һ����Һ�ʵ���ɫ��
��1������ʵ���֪��Na2S����________�ԡ�
��2����ͬѧԤ��ʵ��I��S2�C��������![]() ��
��
�ٸ���ʵ��������ͬѧ��Ϊ��Ԥ�ⲻ������������________��
����ͬѧȡʵ��I��������Һ����ʵ�飬����![]() ���ó�S2�C��������
���ó�S2�C��������![]() �Ľ��ۣ���ͬѧ���˸ý��ۣ�������________��
�Ľ��ۣ���ͬѧ���˸ý��ۣ�������________��
��ͬѧ�Ǿ����ۺ����������ʵ�飬֤ʵ��������![]() ��ȷ���Խ�S2�C������
��ȷ���Խ�S2�C������![]() ��
��
a.�Ҳ��ձ��е���Һ��________��
b.��ͨ�������ָ��ƫת��һ��ʱ���________�������������
��3��ʵ��I������������i���ڲ��죬��ԭ���������ɵIJ��Mn2+��������ķ�Ӧ�![]() ��������Ӧ���÷�Ӧ�����ӷ���ʽ��________��
��������Ӧ���÷�Ӧ�����ӷ���ʽ��________��
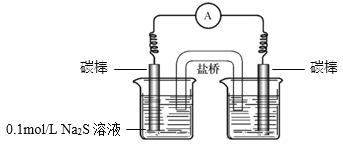
��4��ʵ��II������������Ҳ����ȫ�������ͬѧ������ԭ���루3�����ƣ�����֤�������������ʵ�鷽����______��
��5����˼��ʵ�飬��Ӧ����ͬ��������ͬ�����������ʱ仯�������������������йأ�����________�����йء�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A. ���ʯ�����е���С̼����6��̼ԭ�ӹ���
B. Na2O2����������������������Ŀ֮��Ϊ1��1
C. 1 mol SiO2�����к�2 mol Si��O��
D. ���ʯ��ѧ�����ȶ����ڸ�����Ҳ�����O2��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ����ķ�����ᴿ�������õķ����У����ˡ�������������ȡ�����������ȷֽ�ȣ����и�������ķ�����ᴿӦ����ʲô������
��1��ʵ�����е�ʯ��ˮ���ã�Һ���ϳ�������CaCO3���������ķ�����ȥCa��OH��2��Һ��������CaCO3������
��2��ʵ��������ȡ��Fe��OH��3�����г�����������Cl�� �� �����ķ�����ȥFe��OH��3�����л��е�����Cl�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н����ڳ��������γ����ܵ������ﱡĤ���Ӷ��ܱ����ڲ�������ǣ� ��
A.CuB.AlC.FeD.Na
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ����
A. ��֪25��ʱNH4CNˮ��Һ�Լ��ԣ���25��ʱ�ĵ���ƽ�ⳣ��K(NH3��H2O)>K(HCN)
B. 25��ʱ��Mg(OH)2������20 mL 0.01 mol��L-1��ˮ�е�Ksp����20 mL0.01 mol��L-1NH4Cl��Һ�е�KspС
C. pH��ֽ���������ˮ��pHΪ4.5
D. FeCl3��Һ��Fe2(SO4)3��Һ�������ɡ����ն��õ�Fe2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijKNO3��Һ�к�����KCl��Ca��NO3��2 �� ������ȥ���ʣ��õ�������KNO3��Һ��������Լ�����ȷ˳���ǣ� ��
A.AgNO3��K2CO3
B.AgNO3��K2CO3��HNO3
C.K2CO3��AgNO3
D.K2CO3��AgNO3��HNO3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com