
| A. | H2O→H2 | B. | CuO→Cu | C. | Fe3+→Fe2+ | D. | Zn→Zn2+ |
分析 变化中某元素的化合价降低,发生还原反应,则一般需要加入还原剂才能实现氧化还原反应.注意通过分解反应可以实现的,不一定需要加入还原剂.
解答 解:A.H元素化合价降低,但可通过电解生成,无需加入还原剂,故A错误;
B.Cu元素化合价降低,被还原,应加入还原剂才能实现,故B正确;
C.Fe元素化合价降低,被还原,应加入还原剂才能实现,故C正确;
D.Zn元素化合价升高,被氧化,应加入氧化剂,故D错误.
故选BC.
点评 本题考查氧化还原反应,明确元素的化合价降低时物质被还原、元素的化合价升高时被氧化是解答本题的关键,注意注意通过分解反应可以实现的,不一定需要加入还原剂或氧化剂,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃ | B. | 1.01×103Pa | C. | 101kPa | D. | 0℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L | B. | 0.5 L | C. | 0.25 L | D. | 0.125L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: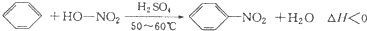
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力.
保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力. )必须密闭干燥存储以防止发生水解,其水解的化学方程式为
)必须密闭干燥存储以防止发生水解,其水解的化学方程式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃时,20mL3mol/L的X溶液 | B. | 20℃时,30mL2mol/L的X溶液 | ||
| C. | 20℃时,20mL4mol/L的X溶液 | D. | 10℃时,10mL2mol/L的X溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com