
对于反应A+B=C,下列条件的改变一定能使化学反应速率加快的是
A.增加A的物质的量 B.升高体系的温度
C.减少C的物质的量 D.增加体系的压强
科目:高中化学 来源:2016届河南省高三三模理综化学试卷(解析版) 题型:选择题
分子式C9H10O2的有机物,其结构中含有苯环且可以与饱和NaHCO3溶液反应放出气体的同分异构体有(不考虑立体异构)
A.12种 B.13种 C.14种 D.15种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安长安一中高二下第二次月考化学卷(解析版) 题型:选择题
己烷雌酚的一种合成路线如下:

下列叙述正确的是( )
A.在NaOH水溶液中加热,化合物X可发生消去反应
B.在一定 条件,化合物Y不能与HCHO发生缩聚反应
条件,化合物Y不能与HCHO发生缩聚反应
C.用FeCl3溶 液可鉴别化合物X和Y
液可鉴别化合物X和Y
D.1mol化合物Y可消耗3mol溴水发生取代反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下第三次考试化学试卷(解析版) 题型:推断题
已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z 原子的最外层电子数之和。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)上述元素两两形成的化合物中,溶于水显碱性的气态氢化物的电子式为 ,含有离子键和非极性 共价键的化合物的电子式为 ;含有极性共价键和非极性共价键的化合物的电子式为 。
共价键的化合物的电子式为 ;含有极性共价键和非极性共价键的化合物的电子式为 。
(2)由X、Y、Z所形成的常见离子化合物是 (写化学式),该化合物与[W的最高价氧化物对应水化物的浓溶液加热时反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下第三次考试化学试卷(解析版) 题型:选择题
某饱和一元醇C 7H15OH发生消去反应,只得到两种单烯烃,则该醇的结构简式可能是下列中的

查看答案和解析>>
科目:高中化学 来源:2016届海南省高三全真模拟二化学试卷(解析版) 题型:填空题
Ⅰ.化学与科学、技术、社会、环境密切相关,下列做法中正确的是__________。
A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放
B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
C.为了有效的发展清洁能源,采用电解水的方法大量制备H2
D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体
II.浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,下图是海水加工的示意图,根据下图回答问题。
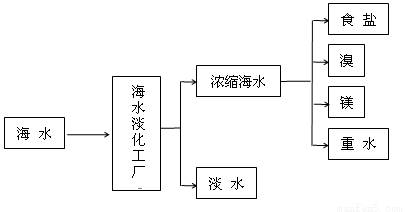
(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。

(3)制备金属镁是通过电解熔融的MgC12,而不用MgO,其原因是 。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是 。
(5)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:3SiCl4(g)+2H2(g)+Si(g) 4SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L。若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为 kg。
4SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L。若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为 kg。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三全真模拟二化学试卷(解析版) 题型:实验题
工业上常常利用物质的酸碱性分离混合物.某一混合物含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如图。
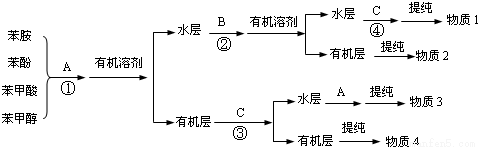
已知:①苯胺(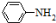 )有弱碱性,可与盐酸等反应生成盐;
)有弱碱性,可与盐酸等反应生成盐;
②常温下,苯胺、苯酚、苯甲酸、苯甲醇微溶于水,但均易溶于有机溶剂。
回答下列问题:
(1)写名称:物质2是 ,物质4是 。
(2)写出A、C的化学式:A , C 。
(3)写出反应②的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三十二模理科化学试卷(解析版) 题型:简答题
随着化石能源的大量开采以及污染的加剧,污染气体的治理和开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成;
SO2(g) + I2(g) + 2H2O(g) = 2HI(g) + H2SO4(l) ∆H=a kJ/mol ①
2H2SO4(l) = 2H2O(g) + 2SO2(g) + O2(g) ∆H= b kJ/mol ②
2HI(g) = H2(g) + I2(g) ∆H= c kJ/mol ③
则2H2O(g) = 2H2(g) + O2(g) ∆H= kJ/mol
(2)CO2 和CH4 是两种重要的温室气体,以表面覆盖有Cu2Al2O4 的二氧化钛为催化剂。可以将CO2 和CH4直接转化为乙酸。

①不同温度下催化剂的催化效率与乙酸的生成速率如图Ⅰ所示,该反应体系应将温度控制在 ℃左右。
②将Cu2Al2O4 溶解在稀硝酸中的离子方程式为 。
(3)甲醇(CH3OH)被称为21世纪的新型燃料。在体积为V L的某反应容器中,a mol CO与2a mol H2 在催化剂作用下反应生成甲醇:CO(g) + 2H2(g)  CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
①该反应是 (填“放热”或“吸热”)反应
②在其他条件不变的情况下,反应容器中再增加amol CO与2amolH2 ,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
③100℃,反应CH3OH(g)  CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
(4)某实验小组设计了如图III所示的甲醇燃料电池装置。
①该电池工作时,OH- 向 (填“a”或“b”)极移动
②工作一段时间后,测得该溶液的pH减小,该电池负极反应的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北武邑中学高一下第二次月考化学试卷(解析版) 题型:选择题
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质。下列分析不正确的是

A.电子经外电路流向Pt电极
B.电池工作时,电解质中Ag+数目减少
C.正极反应:Cl2+2e—+2Ag+ = 2AgCl
D.空气中c(Cl2)越大,Ag极消耗速率越快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com