

分析 A、J是日常生活中常见的两种金属,分别为Al、Fe中的一种,A能与氢氧化钠溶液反应,可推知A为Al,故反应①为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由C→E→H→A→J的转化可知,C为NaAlO2,E为Al(OH)3,H为Al2O3,H→A为工业冶炼金属铝,A→J为铝热反应,J在化合物中存在两种正价,故J为Fe、M为FeS.则D为H2,F常温下是气体,与氢气化合生成G,G能连续氧化生成K,K与水反应生成L,中学中只有N元素单质化合物符合,可推知F为N2,G为NH3,I为NO,K为NO2,L为HNO3,以此解答该题.
解答 解:(1)Al与氢氧化钠溶液反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,反应中水为氧化剂,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;H2O;
(2)稀硝酸溶液与足量铁反应生成硝酸亚铁和NO,化学方程式为3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,
故答案为:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O;
(3)含Al元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色,说明含有钾元素,判断X为KAl(SO4)2,X的水溶液与NaHCO3溶液混合,铝离子和碳酸氢根离子水溶液中双水解反应生成氢氧化铝沉淀和二氧化碳,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3+3CO2↑.
点评 本题考查无机物推断,为高频考点,侧重于学生的分析能力的考查,涉及Al、Fe、N元素单质化合物的转化关系,难度中等,注意基础知识的全面掌握.


科目:高中化学 来源: 题型:选择题
| A. | 淀粉和淀粉酶混合后微热 | |
| B. | 用蘸有质量分数为75%的酒精棉花球擦皮肤 | |
| C. | 用紫外线光灯照射病房 | |
| D. | 用福尔马林浸动物标本 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不是在室温下 | B. | 弱酸溶液与强碱溶液反应 | ||
| C. | 强酸溶液与强碱溶液反应 | D. | 二元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
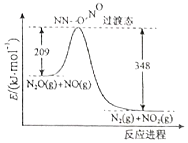 请完成下列问题
请完成下列问题| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH-、NO3-、CO32-、SO42-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH-、NO3-、CO32-、SO42-.为了进一步确认,对该溶液进行实验检测:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 弱酸 | HNO2 | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | Ki=5.1×10-4 | Ki=2.98×10-8 | $\begin{array}{l}{K_{i1}}=4.3×{10^{-7}}\\{K_{i2}}=5.6×{10^{-11}}\end{array}$ | $\begin{array}{l}{K_{i1}}=1.54×{10^{-2}}\\{K_{i2}}=1.02×{10^{-7}}\end{array}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com