
【题目】根据某种共性,可将CO2、P2O5、SO2归为一类,下列物质中完全符合此共性而能归为此类物质的是
A.CaOB.SiO2C.COD.H2O
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】己知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重ag,另一电极上产生标准状况下的气体VmL。下列说法正确的是

A. 铜电极连接电源正极 B. 铜的相对原子质量的计算式是![]()
C. 黑色粉末X是铁粉 D. 石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,Ksp(AgCl)=1.56×10-10 mol2·L-2,Ksp(Ag2CrO4)=1.12×10-12 mol3·L-3,下列叙述正确的是
A.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
B.向2.0×10-4 mol·L-1的K2CrO4溶液中加入等体积的2.0×10-4 mol·L-1 AgNO3 溶液,则有Ag2CrO4沉淀生成
C.将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大
D.将0.001 mol·L-1的AgNO3 溶液逐滴滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4的混合溶液中,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入9.6ml(密度约为1.27g.ml-1)苯甲酸和20mL甲醇(密度约0.79g·mL﹣1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1) 加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)浓硫酸的作用是 混合液体时最后加入浓硫酸的理由: 。
(3)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点最好采用装置 (填“甲”或“乙”或“丙”)。

Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中含有少量甲醇、硫酸、苯甲酸和水,现拟用下列流程进行精制,请根据流程图写出操作方法的名称,操作Ⅱ 。

(5)不能用NaOH溶液代替饱和碳酸钠溶液的原因是 。
(6)列式计算,苯甲酸甲酯的产率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中进行如下反应:X(g)+3Y(g)![]() 2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
A. X为0.25mol/L,Z为0.5mol/L B. Y为1.2mo1/L
C. X为0.3mol/L,Z为0.3mol/L D. Z为0.6mo1/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(19分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
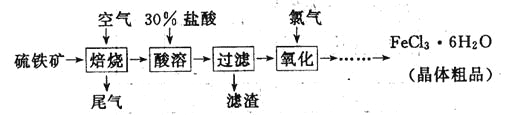
(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
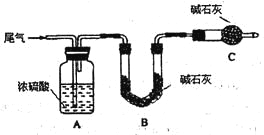
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3![]() 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com