
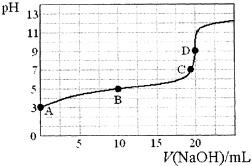
 已知:H3PO2是一元中强酸.25℃,向20mL 0.1mol•L-1的H3PO2溶液中滴加0.1mol•L-1的NaOH溶液(滴定过程中溶液温度保持不变),滴定曲线如图,则下列说法不正确的是( )
已知:H3PO2是一元中强酸.25℃,向20mL 0.1mol•L-1的H3PO2溶液中滴加0.1mol•L-1的NaOH溶液(滴定过程中溶液温度保持不变),滴定曲线如图,则下列说法不正确的是( )| A. | H3PO2的电离方程式为:H3PO2?H2PO2-+H+ | |
| B. | 常温下,Ka(H3PO2)≈10-5 | |
| C. | 该滴定实验中,用酚酞作指示剂比用甲基橙作指示剂的误差小 | |
| D. | B点溶液中存在关系:c(H+)+c(H3PO2)=c(OH-)+c(H2PO2-) |
分析 A、H3PO2是一元中强酸;
B、根据电离方程式结合电离平衡常数进行相关计算;
C、滴定终点时溶液呈碱性;
D、B点溶液为等浓度的NaH2PO2和H3PO2,根据溶液中的电荷守恒、物料守恒来回答判断.
解答 解:A、H3PO2是一元中强酸,所以电离方程式为:H3PO2?H2PO2-+H+,故A正确;
B、一定pH下,电离出的离子为H2PO2-,所以H3PO2是一元弱酸,电离方程式为:H3PO2?H2PO2-+H+;当滴加0.1mol•L-1的NaOH溶液0mL,得到溶液的pH=3,根据电离平衡常数K=$\frac{c({H}_{2}P{{O}_{2}}^{-})•c({H}^{+})}{c({H}_{3}P{O}_{2})}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=10-5,故B正确;
C、滴定终点时溶液呈碱性,所以用酚酞作指示剂比用甲基橙作指示剂的误差小,故C正确;
D、B点溶液为等浓度的NaH2PO2和H3PO2,存在电荷守恒关系:①c(Na+)+c(H+)=c(OH-)+c(H2PO2-),存在物料守恒:②2c(Na+)=c(H3PO2)+c(H2PO2-),①×2-②整理得到2c(H+)+c(H3PO2)=2c(OH-)+c(H2PO2-),故D错误;
故选D.
点评 本题考查学生弱电解质的电离、盐的水解原理的应用以及酸碱中和滴定的有关知识,属于综合知识的考查,注意图象的理解和应用是关键,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.037 | 0.075 | 0.074 | 0.099 |
| A. | Y、Z、W处于周期表中同一周期 | B. | 通常状况下得不到纯净的YZ2 | ||
| C. | X与Z形成的化合物不含非极性键 | D. | X、Z、W形成的化合物为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
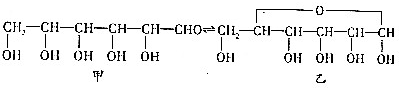
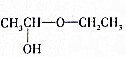 试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→
试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→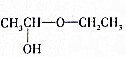 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
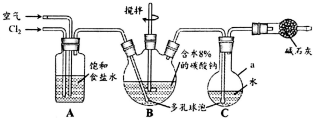 次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.
次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | 25℃时,PH=1的醋酸溶液中含有H+的数目小于0.1NA | |
| C. | 在NaHS溶液中滴入CuCl2溶液产生黑色沉淀,HS-水解程度增,pH增大 | |
| D. | 3种pH相同的溶液①CH3COONa ②NaHCO3 ③NaOH中c(Na+)的大小是①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的名称可能为 2-甲基-5-乙基己烷 | |
| B. | 苯的四氯代物共有三种不同的结构 | |
| C. | 等物质的量的乙烯与碳酸二甲酯(CH3OCOOCH3)完全燃烧的耗氧量不同 | |
| D. | 同为高分子化合物的淀粉、植物油和蛋白质,其水解产物中均含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
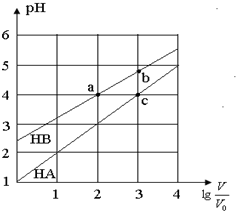 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数a<b | |
| B. | 溶液中水的电离程度:a=c>b | |
| C. | 相同条件下NaA溶液的pH小于NaB溶液的pH | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若同时微热两种溶液(不考虑HA、HB和H2O的挥发),则$\frac{c({B}^{-})}{c({A}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com