
| A. | ①④⑦ | B. | ②⑤⑧ | C. | ③⑥⑨ | D. | 全部 |
分析 ①明矾和FeCl3可作净水剂依据铝离子、铁离子水解生成胶体分析判断;
②加入盐酸抑制铁离子的水解;
③盐酸抑制氯化铝的水解;
④铵根离子和锌离子水解显酸性;
⑤碳酸根、硅酸根离子水解显碱性和玻璃中的二氧化硅反应;
⑥碳酸氢根离子与铝离子发生双水解生成二氧化碳;
⑦铵根离子、铝离子水解显酸性;
⑧铵根离子水解呈酸性,碳酸根离子水解显碱性;
⑨AlCl3是强酸弱碱盐,加热蒸干时水解被促进.
解答 解:①明矾和FeCl3可作净水剂依据铝离子、铁离子水解生成胶体具有较大的表面积,具有吸附悬浮杂质的作用;故①有关;
②加入盐酸抑制铁离子的水解;Fe3++3H2O?Fe(OH)3+3H+;故②有关;
③盐酸抑制氯化铝的水解;Al3++3H2O?Al(OH)3+3H+;故③有关;
④铵根离子和锌离子水解显酸性,和铁锈反应,可以除去铁锈,故④有关;
⑤碳酸根、硅酸根离子水解显碱性和玻璃中的二氧化硅反应,把玻璃瓶塞和瓶口粘结;故⑤有关;
⑥碳酸氢根离子与铝离子发生双水解生成二氧化碳,可以灭火;故⑥有关;
⑦铵根离子、铝离子水解显酸性,镁和氢离子反应促进水解进行生成氢气;故⑦有关;
⑧铵根离子水解呈酸性,草木灰中的碳酸根离子水解显碱性,二者发生相互促进的水解反应,生成氨气,挥发降低肥效;故⑧有关;
⑨AlCl3是强酸弱碱盐,水解出氢氧化铝和盐酸,而盐酸是挥发性酸,加热蒸干时盐酸挥发从而氯化铝的水解被促进,能彻底水解生成氢氧化铝,故⑨有关.
故选D.
点评 本题考查了盐类水解的分析判断,水解离子的特征性质和溶液酸碱性的分析判断,理解盐类水解的实质是弱离子结合水中氢离子或氢氧根离子生成弱电解质,题目难度中等.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 合成氨技术实现了“从空气到面包” | |
| B. | 合成氨涉及氧化还原反应 | |
| C. | 高效催化剂是合成氨反应的重要条件 | |
| D. | 合成氨所需要的氢气主要来自于电解水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的催化重整和煤的干馏均可以得到芳香烃,说明石油和煤中含有芳香烃 | |
| B. | 石油裂解的目的主要是为了得到更多的汽油 | |
| C. | 石油分馏得到的产物可用来萃取溴水中的溴 | |
| D. | 石油裂化主要得到的是乙烯、丙烯等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、SO42-、NO3- | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、HCO3-、Ba2+、Na+ | D. | H+、Fe2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ||||||
| ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
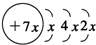 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了泡利原理和洪特规则.
,这样排布遵循了泡利原理和洪特规则. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种新元素 | |
| B. | 它和O3互为同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{2}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P4和CO2中只含有共价键 | |
| B. | CCl4和NH3的立体构型都是正四面体 | |
| C. | BF3中各原子均达到8电子的稳定结构 | |
| D. | 甲烷是对称的平面形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与CO2的反应既是氧化还原反应,又是放热反应 | |
| B. | Ba(OH)2•8H2O与NH4Cl的反应是放热反应 | |
| C. | 化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因 | |
| D. | 反应物的总能量大于生成物的总能量的反应是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com