
(10分)如右图所示,常温下电解5 min后,铜电极质量增加2.16g。
试回答:
(1)电源电极X名称为_______(填“正极”或“负极”)。
(2)电解池B中阴极的电极反应式是__________。
(3)若A中KCl溶液的体积是200mL,电解后溶液的
pH=_________(忽略电解前后溶液体积的变化)。
若要使电解后的溶液恢复到与电解完完全相同,应加入的物质是__________。
(4)已知在l0lkPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,则CH4完全燃烧的热化学方程式为__________。
(1)负极 ,(2)Ag++e- === Ag (3)13,HCl
(4) CH4(g)+O2(g)=== CO2(g)+2H2O(l) △H = - 891.45kJ/mol
【解析】
试题分析:(1)由铜电极的质量增加,发生Ag++e-=Ag,则Cu电极为阴极,可知X为电源的负极,Y为电源正极;(2)B中阴极反应为Ag++e-=Ag;(3)由A中发生2KCl+2H2O 2KOH+;依据上述计算可知电路中转移电子0.02mol,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化则c(OH-)=0.02mol/0.2L=0.1mol?L-1,c(H+)=10-13mol/L,pH=13;因为有H2和Cl2析出,故应加入HCl可使之恢复原状态。(4)2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,故1mol CH4放出的热量为891.45kJ,所以CH4完全燃烧的热化学方程式为CH4(g)+O2(g)=== CO2(g)+2H2O(l) △H = - 891.45kJ/mol。
2KOH+;依据上述计算可知电路中转移电子0.02mol,由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化则c(OH-)=0.02mol/0.2L=0.1mol?L-1,c(H+)=10-13mol/L,pH=13;因为有H2和Cl2析出,故应加入HCl可使之恢复原状态。(4)2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,故1mol CH4放出的热量为891.45kJ,所以CH4完全燃烧的热化学方程式为CH4(g)+O2(g)=== CO2(g)+2H2O(l) △H = - 891.45kJ/mol。
考点:考查电解原理、热化学方程式等相关知识。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2013-2014浙江省五校高三第二次联考理综化学试卷(解析版) 题型:填空题
硫酸亚铁是一种重要的化工原料,可以制备一系列物质。下列说法错误的是( )

A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二下学期期中考试化学试卷(解析版) 题型:选择题
有下述有机反应类型①消去反应,②水解反应,③加聚反应,④加成反应,⑤还原反应,⑥氧化反应,已知CH2Cl-CH2Cl+2H2O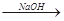 CH2OH-CH2OH+2HCl ,以丙醛为原料制取1,2-丙二醇,所需进行的反应类型依次是( )
CH2OH-CH2OH+2HCl ,以丙醛为原料制取1,2-丙二醇,所需进行的反应类型依次是( )
A.⑥④②① B.⑤①④② C.①③②⑤ D.⑤②④①
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省豫东、豫北十所名校高三阶段性测试理综化学试卷(解析版) 题型:填空题
(14分)工业上可用软锰矿浆(主要成分为MnO2)吸收硫酸厂废气SO2,并制备MnSO4.H2O晶体,其工艺流程如下:

已知:①浸出液的pH<2,且阳离子主要是Mn2+,以及少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:

请回答下列问题:
(1)浸出液pH <2的原因可能是_________________________________________。
(2)加入MnO2,氧化时溶液中反应的离子方程式为________________________ ,若流程中取消“加入MnO2”,对上述流程的影响是________________________________________。
(3)试剂X________(填“能”或“不能”)选用氢氧化锰,试说明理由:____________
______________________________________________________________________________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是______________________
______________________________________________________________________________。
(5)从滤液中提取MnSO4.H2O晶体的操作是____________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省豫东、豫北十所名校高三阶段性测试理综化学试卷(解析版) 题型:选择题
芳香化合物M的结构简式为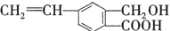 ,关于有机物M的说法正确的是
,关于有机物M的说法正确的是
A.有机物M的分子式为C10H12O3
B.1 molNa2CO3最多能消耗1 mol有机物M
C.1 mol M和足量金属钠反应生成22.4 L气体
D.有机物M能发生取代、氧化和加成反应
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:选择题
某研究性学习小组进行电化学实验,研究装置如图所示。
有关说法不正确的是
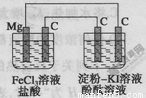
A.镁为负极
B.原电池中碳极的电极反应式为Fe3++e-=Fe2+
C.电解池中阳极处先变红
D.电解池中阴极的电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c (H+)=1 ×10 mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.c (Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
D.c (H+)/c (OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高三第二次模拟考试理综化学试卷(解析版) 题型:简答题
(14分)固体A可用于工业上生产硫酸,各物质间转化如下图。其中C为红棕色粉
末,D为能使品红溶液褪色的无色气体。
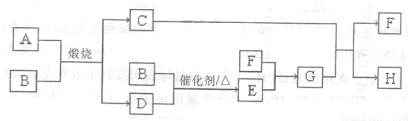
请回答:
(1)F的电子式为_________。
(2)若测得生成C和D的质量比为5:8,则A的化学式为______________。
(3)将D通入H溶液中发生反应的离子方程式为_____________。
(4)物质的量浓度均为0.lmol/L的G和H的混合溶液中,离子浓度由大到小的顺序
为____________。
(5)有人用电解某饱和溶液的方法同时制备G的浓溶液和浓氢氧化钠溶液,如图所
示。则:

①a端为电源的_________(填“正极”或“负极”)。
②N口收集的物质为__________(填化学式,下同。);
Q口收集的为_________浓溶液。
③某物质的饱和溶液最好选用___________(填试剂名称)。
④阳极的电极反应式为____________。
(6)检验H中金属阳离子的方法___________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三年级第三次考试理综化学试卷(解析版) 题型:简答题
(15分)用磷灰石制磷肥的副产品六氟硅酸钠(Na2SiF6)可制冰晶石(Na3AlF6),冰晶石是电解铝的助熔剂,可降低氧化铝的熔点。下图是工业制铝的流程图:

(1)工业上从铝土矿制备较高纯度Al2O3的主要工艺流程需__________个环节,第一步反应的方程式______________________________________________________________
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是________溶液,滤渣是________ 。
(3)分解脱硅和合成冰晶石化学反应方程式分别为:_________________、____________________。
(4)工艺过程中③和④的目的是_____________________,碳酸钠和二氧化碳是否够用 。
(5)电解Al2O3制Al时,I=200kA,一天制Al 1.430 t,电解效率是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com