
分析 n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol,收集得到气体物质的量=$\frac{1.792L}{22.4L/mol}$=0.08mol,根据转移电子守恒,如果生成的是NO,则n(NO)=$\frac{0.05mol×2}{3}$=0.033mol,如果生成二氧化氮,其物质的量=$\frac{0.05mol×2}{1}$=0.1mol,0.033mol<0.08mol<0.1mol,所以生成的气体是二氧化氮、NO的混合物;
(1)参加反应的硝酸包含生成氮氧化物、生成硝酸铜的物质的量,所以消耗n(HNO3)=$\frac{1}{2}$n[Cu(NO3)2]+n(NOx)=$\frac{1}{2}$n(Cu)+n(NOx);
(2)被还原的硝酸生成氮氧化物,根据N原子守恒计算被还原硝酸物质的量;
(3)该反应中Cu失电子、硝酸得电子,可以根据Cu计算转移电子物质的量.
解答 解:n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol,收集得到气体物质的量=$\frac{1.792L}{22.4L/mol}$=0.08mol,根据转移电子守恒,如果生成的是NO,则n(NO)=$\frac{0.05mol×2}{3}$=0.033mol,如果生成二氧化氮,其物质的量=$\frac{0.05mol×2}{1}$=0.1mol,0.033mol<0.08mol<0.1mol,所以生成的气体是二氧化氮、NO的混合物;
(1)参加反应的硝酸包含生成氮氧化物、生成硝酸铜的物质的量,所以消耗n(HNO3)=$\frac{1}{2}$n[Cu(NO3)2]+n(NOx)=$\frac{1}{2}$n(Cu)+n(NOx)=$\frac{1}{2}$×0.05mol+0.08mol=0.105mol,
答:反应中消耗HNO3的物质的量是0.105mol;
(2)被还原的硝酸生成氮氧化物,根据N原子守恒计算被还原硝酸物质的量=n(NOx)=0.08mol,
答:被还原硝酸的物质的量为0.08mol;
(3)该反应中Cu失电子、硝酸得电子,可以根据Cu计算转移电子物质的量=0.05mol×2=0.1mol,
答:转移电子的物质的量是0.1mol.
点评 本题考查氧化还原反应有关计算,为高频考点,明确各个物理量之间关系是解本题关键,利用原子守恒、转移电子守恒解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{3}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{2}$ | D. | $\frac{1}{6}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取等量的硝酸铜,需硝酸的量②最少 | |
| B. | 制取等量的硝酸铜,②产生的有毒气体比①少 | |
| C. | 三种方案中,硝酸的利用率为③>①>② | |
| D. | 三种方案的反应都可以在铁质容器中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
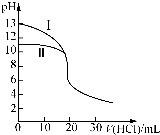 室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )
室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )| A. | Ⅱ表示的是滴定氨水的曲线,当V(HCl)=20 mL时,有:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 当pH=7时,滴定氨水消耗的V(HCl)=20 mL,且c(NH4+)=c(Cl-) | |
| C. | 滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(NH4+)-c(NH3•H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com