


科目:高中化学 来源: 题型:
| A、加热能杀死H1N1流感病毒是因为病毒蛋白质受热变性 |
| B、不锈钢是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 |
| C、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| D、加碘食盐中主要添加的是碘化钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
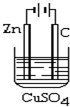 电解原理在工业有广泛的应用.利用相关知识回答下面的问题.
电解原理在工业有广泛的应用.利用相关知识回答下面的问题.查看答案和解析>>
科目:高中化学 来源: 题型:
A、2CO+O2
| ||||
| B、CaO+H2O=Ca(OH)2 | ||||
C、C+H2O
| ||||
| D、CO2+Ca(OH)2=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.5 | 8.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com