
【题目】有机物M(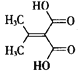 )是一种重要的化工原料。下列有关M的说法不正确的是( )
)是一种重要的化工原料。下列有关M的说法不正确的是( )
A.与 互为同分异构体
互为同分异构体
B.能使酸性高锰酸钾溶液褪色
C.能发生加成反应、取代反应和氧化反应
D.1 molM分别与足量的Na、NaHCO3溶液反应,产生气体的物质的量之比为1:1
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 18g重水(D2O)所含的电子数目为10NA
B. Na2O2与足量的水反应生成1 molO2,转移电子数目为2NA
C. 100 mL1 molL-1 FeCl3溶液中含有 Fe3+数目为 0.1NA
D. 将2molSO2和1molO2充分反应,转移的电子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是
A.熔融状态下的NaHSO4电离:NaHSO4=Na++H++SO42-
B.H2CO3的电离:H2CO3![]() 2H++CO32-
2H++CO32-
C.Fe(OH)3的电离:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.水溶液中的NaHSO4电离:NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的( )
A. 在稀溶液中,![]() ;
;![]() ,若将含
,若将含![]() 的硫酸与含1molNaOH的溶液混合,放出的热一定为
的硫酸与含1molNaOH的溶液混合,放出的热一定为![]()
B. 由![]() 石墨
石墨![]() 金刚石
金刚石![]() :
:![]() 可知,金刚石比石墨稳定
可知,金刚石比石墨稳定
C. 实验测得环己烷![]() 、环己烯
、环己烯![]() 和苯
和苯![]() 的标准燃烧分别为
的标准燃烧分别为![]() 、
、![]() 和
和![]() ,可以证明在苯分子中不存在独立的碳碳双键
,可以证明在苯分子中不存在独立的碳碳双键
D. 在101kPa时,![]() 完全燃烧生成液态水,放出
完全燃烧生成液态水,放出![]() 热量,则表示氢气燃烧热的热化学方程式为:
热量,则表示氢气燃烧热的热化学方程式为:![]() ;
;![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应热的描述正确的是![]()
![]()
A.稀![]() 与NaOH固体反应生成
与NaOH固体反应生成![]() 放出的热量为中和热
放出的热量为中和热
B.反应条件与反应所需活化能有关,与反应热无关
C.若一个反应的反应物总键能大于生成物总键能,则反应![]()
D.已知![]() 的燃烧热为
的燃烧热为![]() ,则完全燃烧
,则完全燃烧![]() 生成水蒸气放出的热量大于
生成水蒸气放出的热量大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2的燃烧热为ΔH=-285.8 kJ·mol-1,CO的燃烧热为ΔH=-282.8 kJ·mol-1;现有H2和CO组成的混合气体5.6 L(标准状况),经充分燃烧后,放出总热量为71.15 kJ,并生成液态水。下列说法正确的是
A. CO燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-282.8 kJ·mol-1
B. H2燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1
C. 燃烧前混合气体中CO的体积分数为60%
D. 燃烧后的产物全部与足量的过氧化钠作用可产生0.125 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向浓度均为0.1mol/L、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中lg![]() 随n(NaOH)的变化如下图所示。下列说法不正确的是
随n(NaOH)的变化如下图所示。下列说法不正确的是
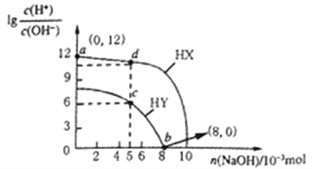
A. HX为强酸,HY为弱酸 B. b点时溶液呈中性
C. 水的电离程度:d>c D. c点时溶液的pH=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11,下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液加入浓NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有下列五种溶液:
① | ② | ③ | ④ | ⑤ |
0.1 mol·L-1 CH3COOH溶液 | 0.01mol·L-1 CH3COOH溶液 | pH=2 CH3COOH溶液 | 0.1 mol·L-1 NaOH溶液 | 0.1mol·L-1 氨水 |
回答下列问题:
(1)溶液①稀释到原来的10倍后的溶液pH______③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①_______④
(2)在相同温度时100mL ②的溶液与10mL ①的溶液相比较,下列数值前者大于后者的是_______ (填字母)。
A .中和时所需NaOH的量 B .电离程度
C .水电离出的c(H+) D. CH3COOH的物质的量
(3)用水稀释⑤时,溶液中随着水量的增加而减小的是______(填字母)。
A.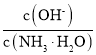 B.
B.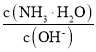
C. c(H+)和c(OH-)的乘积 D.OH-的物质的量
(4)联氨(N2H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:_______________________________________。
(5)已知CH3COOH的电离平衡常数Ka=1.8×10-5 ,另一种二元弱酸H2B的电离平衡常数为K1=4.3×10- 4 ,K2=5.6×10-1 1 试写出向Na2B溶液中加入过量CH3COOH溶液的化学方程式:_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com