
【题目】下列物质在水溶液中的电离方程式正确的是
A. NaHCO3:NaHCO3 ![]() HCO3-+ Na+
HCO3-+ Na+
B. CH3COONH4:CH3COONH4 = NH4++CH3COO-
C. NaHSO4:NaHSO4 = Na+ +HSO4-
D. Fe(OH)3:Fe(OH)3 ![]() Fe(OH)2++2OH-
Fe(OH)2++2OH-
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
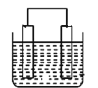
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:_____。
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出B电极反应式:____;该电池在工作时,A电极的质量将____(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1molH2SO4,则转移电子的数目为_____。
(3)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。
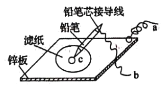
若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现______色,铅笔芯c点处的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
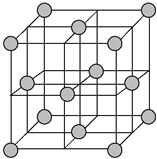
【题目】铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是( )

A. 铁镁合金的化学式为Mg2Fe
B. 晶体中存在的化学键类型为金属键
C. 晶格能:氧化钙>氧化镁
D. 该晶胞的质量是![]() g(NA表示阿伏加德罗常数的值)
g(NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯化铁溶液中存在下列平衡:FeCl3+3H2O![]() Fe(OH)3+3HC1;△H>0。回答下列问题:
Fe(OH)3+3HC1;△H>0。回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体,向这种液
体中加入MgCl2溶液,产生的现象为 。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是 。
(3)在配制FeCl3溶液时,为防止浑浊,应加入 。
(4)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤
后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)按下图所示装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为 ,B池为 ;
(2)锌极为 极,铜极上的电极反应式为 ,
石墨棒C1为 极,电极反应式为 ,
石墨棒C2附近产生的现象为 ;
(3)当C2极析出气体224mL(标准状况),锌的质量变化为 g(“增加”或“减少”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在。
(1)在蛋白质中涉及的氮、氧元素电负性由小到大的顺序是___;基态硫原子的价电子排布式为______。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为____(填化学式)。1 mol CN-中含有的π键的数目为____。
(3)蛋白质分子中氨基(—NH2)氮原子的轨道杂化类型是_____;血液中有一种含铜的呈蓝色的蛋白质分子,与Cu同周期且最外层电子数相等的元素还有______(填元素符号)。
(4)铜晶体为面心立方最密堆积,即在晶体结构中可以分割出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个面上,已知铜的原子半径为127.8 pm,列式计算晶体铜的密度:ρ=___g·cm-3(列出计算式即可)。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数与压强变化的关系如图所示,则下列叙述正确的是( )
pC(g) △H<0,在一定温度下,平衡时B的体积分数与压强变化的关系如图所示,则下列叙述正确的是( )

①m+n<p ②x点的状态是v正>v逆 ③n>p ④x点比y点的反应速度慢 ⑤若升高温度,该反应的平衡常数增大
A. ①②④ B. ②④
C. ③⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
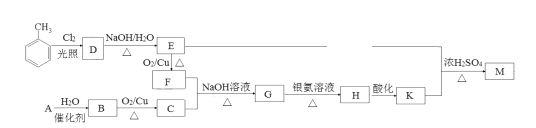
已知:①气态烃A在标准状况下的密度是1.25g/L;
②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:
RCH2-CHO+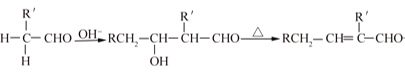 +H2O
+H2O
请回答下列问题:
(1)F的名称是____;G中含有的官能团名称是____。
(2)写出D→E的化学方程式___。
(3)A→B的反应类型是___;M的结构简式是____。
(4)同时满足下列条件的K的同分异构体有___种(不考虑立体异构)。
①遇FeCl3溶液发生显色反应②能发生银镜反应③除苯环以外不再含有其他环状结构
其中核磁共振氢谱为五组峰的结构简式为___。
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯可用下图所示装置。请回答下列问题

(1)关闭G夹,打开B夹,从装有少量苯的三颈烧瓶的A口加少量溴,再加入少量铁屑,塞住A口,三颈烧瓶中发生的主要反应的化学方程式为_________________________________。
(2)试管C中苯的作用是:____________________。试管D中出现的现象是:_____________。试管E中出现的现象是:___________________。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时打开G夹,关闭B夹,可以看到的现象是_______________ 。
(4)三颈烧瓶中的溴苯经过下列步骤分离提纯:
①向三颈烧瓶中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是__________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______。
④经过上述分离操作后,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com