
| 2(d-c) |
| 3 |
| d-c |
| 6 |
| d-c |
| 6 |
| 2(d-c) |
| 3 |
| 8c |
| 3 |
| 2d |
| 3 |
| d-c |
| 6 |
| 8c |
| 3 |
| 2d |
| 3 |
| 8c |
| 3 |
| 2d |
| 3 |
| 2d |
| 3 |
| 8c |
| 3 |
| 2d |
| 3 |
| 8c |
| 3 |


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正反应是吸热反应,m+n<p+q |
| B.逆反应是吸热反应,m+n<p+q |
| C.正反应是吸热反应,m+n>p+q |
| D.逆反应是吸热反应,m+n>p+q |
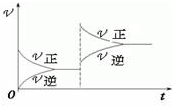
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④⑦ | B.①④⑥ | C.②③⑥⑦ | D.③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
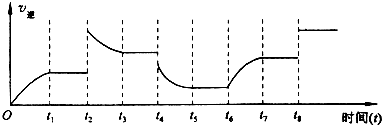
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 催化剂 |
| △ |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
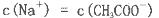
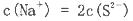
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com