


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源:不详 题型:单选题
| A.铝片与稀盐酸的反应 |
| B.甲烷与氧气的反应 |
| C.灼热的炭与二氧化碳反应生成一氧化碳 |
| D.氢氧化钠溶液与稀盐酸的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Zn+H2SO4(稀) | B.NaCl+AgNO3(溶液) |
| C.H2+O2 | D.Na2O+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+ | B.HS— | C.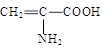 | D.C6H5O— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
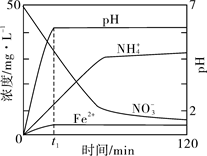
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向A gCl沉淀中滴入稀KI溶液白色沉淀变黄,说明AgI比AgCl更难溶 |
| B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32- |
| C.先加入盐酸无 沉淀,再加入Ba Cl2溶液产生白色沉淀,则试样中一定有SO42- |
| D.盐溶液中加入NaOH微热,产生使湿润的红色石蕊试纸变蓝的气体,则一定是铵盐 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.焰色反应为化学变化 |
| B.用完的铂丝用稀硫酸清洗 |
| C.只有当金属元素为化合态时,才会有焰色反应 |
| D.焰色反应为黄色,则一定有钠元素,钾元素不能确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
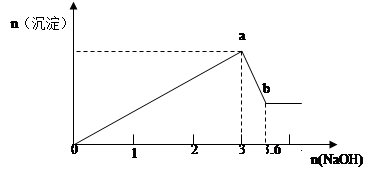
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com