
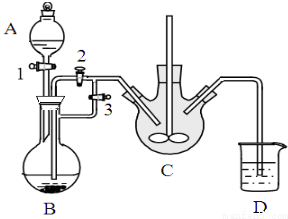
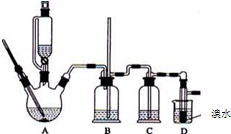
 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,M=288g/mol)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,M=288g/mol)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.分析 (1)(2)亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与盐酸反应制备氯化亚铁,利用反应生成的氢气排尽装置中的空气,故B中Fe与盐酸反应生成氯化亚铁与氢气,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,D中吸收尾气中HCl,防止污染空气.
(3)实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化,过量的铁粉用乳酸除去,Fe被充分利用;
(4)乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大.
解答 解:亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与盐酸反应制备氯化亚铁,利用反应生成的氢气排尽装置中的空气,故B中Fe与盐酸反应生成氯化亚铁与氢气,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,D中吸收尾气中HCl,防止污染空气.
(1)由上述分析可知,稀盐酸盛放在分液漏斗中,即仪器A中,NH4HCO3盛放在装置C中,
故答案为:A;C;
(2)装置C中涉及的主要反应的离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,具体操作为:关闭活塞3,打开活塞2;
故答案为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;关闭活塞3,打开活塞2;
(3)Fe2+离子易被氧化为Fe3+离子,实验目的是制备乳酸亚铁晶体,加入Fe粉,防止Fe2+离子被氧化,过量的铁粉可以充分利用,得到乳酸亚铁,加入适量乳酸让铁粉反应完全,
故答案为:防止Fe2+离子被氧化;加入适量乳酸让铁粉反应完全;
(4)乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%,
故答案为:乳酸根离子中含有羟基,被酸性高锰酸钾溶液氧化.
点评 本题考查实验制备方案,涉及化学仪器识别、对操作的分析评价、物质分离提纯、氧化还原反应滴定应用等,明确原理是解题关键,是对学生综合能力的考查,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.8molCH4 | B. | 66gCO2 | ||
| C. | 标准状况下44.8L的O2 | D. | NA个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
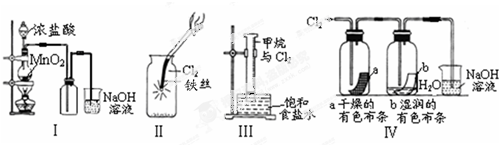
| A. | Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 | |
| B. | Ⅱ图中:有棕黄色的雾生成 | |
| C. | Ⅲ图中:量筒中发生了加成反应 | |
| D. | Ⅳ图中湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
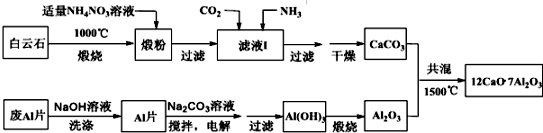
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9 g H2O中含有电子数为NA | |
| B. | 11.2 LCl2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA | |
| D. | 2L 1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素最高化合价:Al>Mg | B. | 金属性:Al>Mg | ||
| C. | 酸性:H2SO4>H3PO4 | D. | 原子半径:Cl>F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com