
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:____。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
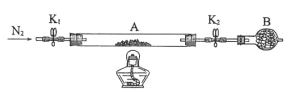
①仪器B的名称是____。
②将下列实验操作步骤正确排序____(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A
f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=____(列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
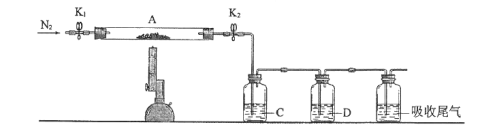
①C、D中的溶液依次为____(填标号)。C、D有气泡,并可观察到的现象分别为____。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式____。
【答案】样品中没有Fe3+,Fe2+易被氧化为Fe3+ 球形干燥管 dabfce ![]() c、a 生成白色沉淀、品红溶液褪色 2FeSO4
c、a 生成白色沉淀、品红溶液褪色 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】
(1)根据Fe3+与SCN-反应溶液变红分析;
(2)①仪器B中装有固体干燥剂,所以B的名称为球形干燥管;
②装置应先通入N2,排净装置中的空气,再点燃酒精灯,开始反应,反应结束后先熄灭酒精灯,使装置冷却到室温后,再关闭K1和K2,进行称量。
③关系式法计算;
(3)该题中FeSO4分解后的红棕色的Fe2O3,由Fe元素化合价升高,可知S元素化合价必有降低,产物之一必为SO2,根据化合价升降守恒和原子守恒可推测另一产物为SO3,据此分析。
(1)溶液中先滴加KSCN溶液,溶液颜色无明显变化,说明绿矾样品中无Fe3+,硫酸亚铁与KSCN不反应;再向试管中通入空气,溶液逐渐变红,则溶液中有Fe3+生成,说明硫酸亚铁易被空气氧化为硫酸铁,Fe3+与KSCN反应,使溶液变红;
答案:样品中没有Fe3+,Fe2+易被氧化为Fe3+
(2)①仪器B中装有固体干燥剂,所以B的名称为球形干燥管;
答案:球形干燥管;
②装置应先通入N2,排净装置中的空气,再点燃酒精灯,开始反应,反应结束后先熄灭酒精灯,使装置冷却到室温后,再关闭K1和K2,进行称量。所以操作步骤顺序为dabfce;
答案:dabfce
③结晶水的数目为x,m3-m1为FeSO4的质量,m2-m3为结晶水的质量;
FeSO4·xH2O~FeSO4~xH2O
152 18x
m3-m1 m2-m3
解得x=![]() ;
;
答案: ![]()
(3)①C、D中均有气泡冒出,则C中溶液为BaCl2,吸收生成的SO3,有白色沉淀生成,而SO2气体不反应,D中溶液为品红溶液,遇到SO2气体会褪色;
答案:c、a 生成白色沉淀、品红溶液褪色
②该题中FeSO4分解后的红棕色的Fe2O3,由Fe元素化合价升高,可知S元素化合价必有降低,产物之一必为SO2,根据化合价升降守恒和原子守恒可推测另一产物为SO3;硫酸亚铁高温分解反应的化学方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑;
Fe2O3+SO2↑+SO3↑;
答案:2FeSO4![]() Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在450℃并有催化剂存在下,在容积恒定的密闭容器内进行下列反应:2SO2 (g)+O2(g)![]() 2SO3(g) △H=-190kJmol-1
2SO3(g) △H=-190kJmol-1
(1)该反应500℃时的平衡常数____450℃时的平衡常数(填“>”、“<”或“=”)。
(2)450℃时,在2L密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是____。
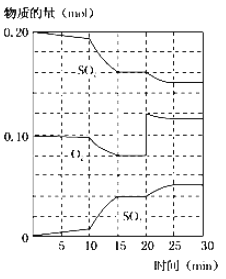
(3)据上图判断,反应进行至20min时,曲线发生变化的原因是___(用文字表达),10min到15min的曲线变化的原因可能是___(填字母)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3物质的量
(4)欲提高SO2的转化率,下列措施可行的是___。(填字母)
a.向装置中充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
II.已知HCl+O2![]() Cl2+H2O(未配平)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:
Cl2+H2O(未配平)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:
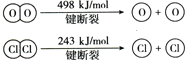
①写出该反应的热化学方程式是_____。
②断开1 mol H—O键与断开 1 mol H—Cl键所需能量相差约为___kJ,H2O中H—O键比HCl中H—Cl键_____(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,对下列电解质溶液的有关说法正确的是
A. 相同浓度和体积的强碱和强酸溶液混合后,溶液的pH一定等于7
B. 在NaHCO3溶液中,c(CO32-)>c(HCO3-)
C. 在AgCl悬浊液中加入NaCl固体,c(Ag+)减小
D. 将pH相等的CH3COONa和NaOH溶液稀释相同倍数后,溶液的pH:CH3COONa<NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)书写下列物质电子式
①NaOH:_______;②CO2:______;③H2O2:_____;
(2)用电子式表示下列物质的形成过程
①MgCl2:________;
②H2O:__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是一种具有退热镇痛作用的药物,可用苯胺和冰醋酸为原料来制备乙酰苯胺。
①化学原理为: (已知:苯胺易被氧化)
(已知:苯胺易被氧化)
②相关物质的物理常数
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度(g) | |
水 | 乙醇 | |||||
苯胺 | 93 | 无色液体 | 6 | 184 | 3.42(20℃) | 任意比混溶 |
冰醋酸 | 60 | 无色液体 | 17 | 118 | 任意比混溶 | 任意比混溶 |
乙酰苯胺 | 135 | 白色片状固体 | 114 | 304 | 0.56(20℃)、3.45(50℃)、5.20(100℃) | 36.9(20℃) |
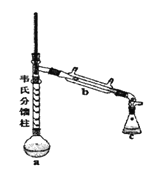
③制各乙酰苯胺的装置如图所示:韦氏分馏柱作用与原理类似于冷凝管。
④制备方法和过程:

(1)仪器a的名称_______。
(2)制备过程中加入锌粒的作用:其一是________、其二是防止暴沸。
(3)从化学平衡的角度分析,步骤1要控制分馏柱上端的温度在105℃左右的原因_____。
(4)步骤2
(5)步骤3中洗涤剂最好选择________。
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(6)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→_____→冷却结晶→过滤→洗涤→干燥。
(7)本实验所得到的乙酰苯胺产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
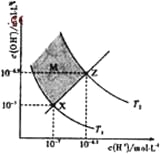
A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
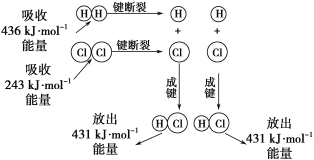
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物既是可导致酸雨的物质,也是造成空气污染的重要物质,加大对氮的氧化物的治理是环境保护重要举措。
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式: _____________________________,该反应中氧化剂是_________,还原剂是________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为___________________________________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收nmol NO2和mmol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为_________ mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=_________。
③用含n和m的代数式表示所得溶液中NO3-和NO2-浓度的比值c(NO3-)∶c(NO2-)=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com