
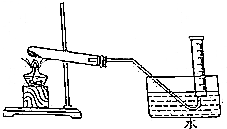
 为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:分析 (1)装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;一般用到的方法是空气热胀冷缩法,据此进行分析解答;
(2)反应结束时应该先撤出导管再移去酒精灯,避免发生倒吸现象;
(3)二氧化锰与草酸钠发生氧化还原反应生成锰离子、二氧化碳气体和水.
解答 解:(1)检查装置的气密性方法为:连接好仪器,先将导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,移开手,在导管内形成一段水柱,则不漏气,
故答案为:导管的一端浸没在水里,双手紧贴容器外壁,观察是否有气泡冒出,移开手,在导管内是否形成一段水柱;
(2)充分加热后,停止加热,为了避免发生倒吸现象,应先将导管移出水面,再移去酒精灯,
2.45g氯酸钾的物质的量为:$\frac{2.45g}{122.5g/mol}$=0.02mol,根据反应2KClO3$\frac{\underline{\;MnO_2\;}}{\;}$2KCl+3O2↑可知,0.02mol氯酸钾完全分解生成氧气的物质的量为:0.02mol×$\frac{3}{2}$=0.03mol,常温下0.03mol氧气的体积为:24.5L/mol×0.03mol=0.735L,由于加热过程中气体膨胀,则量筒内收集到的气体体积>0.735L,
故答案为:将导管移出水面;>;
(3)MnO2与Na2C2O4发生氧化还原反应,反应的离子方程式为:MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O,
故答案为:MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O.
点评 本题考查了化学实验方案的设计与评价,题目难度中等,明确实验目的、实验原理为解答关键,注意掌握呈化学实验方案设计与评价原则,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测得新制氯水的pH为5 | |
| B. | 向某种消毒液(NaClO)中滴加盐酸,能抑制NaClO水解,降低漂白效果 | |
| C. | 铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用 | |
| D. | 为便于储存,需要将氯气液化[Cl2(g)?Cl2(l)],可以采取加压或者升温的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯能发生取代反应、加成反应,还能使酸性KMnO4溶液褪色 | |
| B. | 分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种 | |
| C. | 甲苯中所有原子都处于同一平面 | |
| D. | 相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体60.0g.
Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体60.0g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
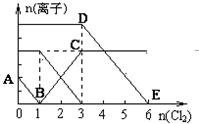 已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe2+物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=3 mol/L | |
| C. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 | |
| D. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池的电极是两种不同的金属 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池负极发生的电极反应是还原反应 | |
| D. | 原电池的正极是还原剂,总是溶液中的阳离子在此被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
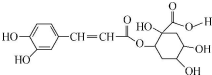
| A. | 每个分子中含有4个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol该有机物只能与1molBr2发生反应 | |
| D. | 1mol该有机物最多与8molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com