
(14 ��) һ����̼���㷺Ӧ����ұ��ҵ�͵��ӹ�ҵ��
�Ÿ�¯��������Ϊ�ձ��������������ط�Ӧ���Ȼ�ѧ����ʽ���£�
4CO(g)��Fe3O4(s)��4CO2(g)��3Fe(s) ��H="a" kJ��mol��1
CO(g)��3Fe2O3(s)��CO2(g)��2Fe3O4(s) ��H="b" kJ��mol��1
��Ӧ3CO(g)��Fe2O3(s)��3CO2(g)��2Fe(s)�ġ�H= kJ��mol��1(�ú�a��b �Ĵ���ʽ��ʾ)��
�Ƶ��ӹ�ҵ��ʹ�õ�һ����̼���Լ״�Ϊԭ��ͨ�����⡢�ֽ�������Ӧ�õ���
��һ����2CH3OH(g) HCOOCH3(g)+2H2(g) ��H>0
HCOOCH3(g)+2H2(g) ��H>0
�ڶ�����HCOOCH3(g) CH3OH(g) +CO(g) ��H>0
CH3OH(g) +CO(g) ��H>0
�ٵ�һ����Ӧ�Ļ�����������ͼ��ʾ��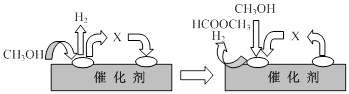
ͼ���м����X�Ľṹ��ʽΪ ��
���ڹ�ҵ�����У�Ϊ���CO�IJ��ʣ��ɲ�ȡ�ĺ�����ʩ�� ��
��Ϊ��������о�����CO��ԭ��������ʯ����Ӧ��������ʵ�X������������ͼ��ͼ��ʾ��X����������������ж�ij��̬�����Ƿ���ڣ���ͬ��̬���ʳ�������������Dz�ͬ������Ӧ�������е�һ�ֲ����������ᷴӦ���������Σ��÷�Ӧ�����ӷ���ʽΪ ��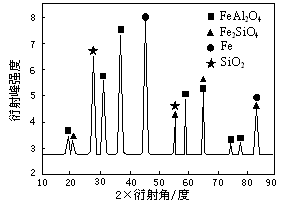
��ij������Ʒ����Ni2O340%������ΪSiO2��ͨ����ԭ���ᴿ������������ʣ�������CO��33.2 g��Ʒ�ڼ��������»�ԭΪ������Ȼ���ڳ�����ʹ�����е�Ni��CO��ϳ�Ni(CO)4���е�43 �棩������180 ��ʱʹNi(CO)4���·ֽ���������ʡ�
��������������CO�����ʵ���֮��Ϊ ��
��Ϊ��ȫ�������ҵ��������Կ����е�CO���м�⡣
�ٷۺ�ɫ��PdCl2��Һ���Լ��������������CO���������к�CO������Һ�л������ɫ��Pd������ÿ����5.3gPd��������Ӧת�Ƶ�����Ϊ ��
��ʹ�õ绯ѧһ����̼���崫����������������CO��������ṹ��ͼ��ʾ�����ִ���������ԭ���ԭ������õ�صĸ�����ӦʽΪ ��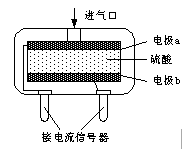
��(2a+b)/3 �Ƣ�HCHO �������¶ȣ�����ѹǿ
��FeAl2O4+8H+��Fe2++2Al3++4H2O ��3:8
�ɢ�0.1mol����0.1NA�� ��CO+H2O��2e����CO2+2H+��ÿ��2�֣���14�֣�
��������������Ž����١�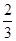 +�ڡ�
+�ڡ�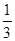 ���ܵø÷���ʽ�����ݸ�˹���ɿɸ÷�Ӧ�ȡ�H��(2a+b)/3 kJ��mol��1��
���ܵø÷���ʽ�����ݸ�˹���ɿɸ÷�Ӧ�ȡ�H��(2a+b)/3 kJ��mol��1��
�Ƣ�CH3OH���������HCHO��
�ڸ��ݵ�һ���͵ڶ����ķ�Ӧ�ص㣬��֪�������¶ȣ�����ѹǿ�������CO�IJ��ʣ�
�Ǹ��ݡ���Ӧ�������е�һ�ֲ����������ᷴӦ���������Ρ�˵���÷�Ӧ�ķ�Ӧ����FeAl2O4�����ᣬ��������FeCl2��AlCl3��H2O���ݴ˱��д�����ӷ���ʽ��
����ȷ��������������Ӧ��3CO+Ni2O3��3CO2+2Ni��Ni+4CO��Ni(CO)4����������������CO�����ʵ���֮��Ϊ3��8��
�ɢٸ��ݡ�PdCl2��Pd��2e-������ÿ����5.3gPd��������Ӧת�Ƶ�����Ϊ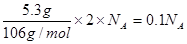 ��
��
��CO�ڸ����Ϸ���������Ӧ���ݵ�ʧ�����غ���CO��2e�D�D�DCO2���پݵ���غ���CO��2e�D�DCO2+2H+������ԭ���غ��CO+H2O��2e����CO2+2H+��
���㣺���黯ѧ��Ӧ����ԭ������Ӧ�ȵļ��㡢ƽ���ƶ�ԭ�������ӷ���ʽ����д��������ԭ��Ӧ����ת�����ļ��㡢�缫��Ӧʽ����д�ȣ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���б仯������������������ڷ�Ӧ�������������( )
| A��H + H = H��H | B��H��Cl =" H" + Cl |
| C��Mg + 2HCl = MgCl2 + H2 �� | D��H2SO4 + 2NaOH = Na2SO4 + 2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣�
��1����ˮ��c(H��)��5.0��10��7mol/L�����ʱ��ˮ�е�c(OH��)�� ��
���¶Ȳ��䣬����ϡ����ʹc(H��)��5.0��10��3mol/L����c(OH��)�� ��
��2����CH3COONa����Һ�У������ӵ����ʵ���Ũ���ɴ�С��˳���� ��
��3��������ˮ��Һ�����ԣ���ԭ���ǣ������ӷ���ʽ��ʾ�� ��
��4����25�桢101kPa�£�0.5mol�ļ״���CH3OH����ȫȼ������CO2��Һ̬ˮʱ�ų�352kJ�����������ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ ��
��5��1L 1 mol��L��1 H2SO4��Һ��2L 1 mol��L��1 NaOH��Һ��ȫ��Ӧ���ų�114.6kJ���������ʾ�к��ȵ��Ȼ�ѧ����ʽΪ ��
��6����֪����N2(g)+2O2(g)��2NO2(g) ��H��+67.7 kJ/mol ��
��N2H4(g)+O2(g)��N2(g)+2H2O(g) ��H����534 kJ/mol
��N2H4��NO2����ȫ��Ӧ���ɵ�������̬ˮ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1�����ø�˹���ɿ��Դ��Ѿ���ȷ�ⶨ�ķ�Ӧ��ЧӦ���������ڲ������ܲ����ķ�Ӧ����ЧӦ����֪��N2(g)+ 2O2(g)="=" 2NO2(g) ��H=" +67.7" kJ��mol-1��
N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ��H=" -534" kJ��mol-1��
��д����̬����NO2������ȫ��Ӧ���ɵ�����ˮ�������Ȼ�ѧ����ʽ�� ��
��2����֪��N��N�ļ�����946kJ��mol-1��H��H�ļ���Ϊ436kJ��mol-1��N��H�ļ�
��Ϊ393kJ��mol-1������ϳɰ���Ӧ����1molNH3�ġ�H�� kJ��mol-1��
��3������25�桢pH��13��Ba(OH)2��Һ��
�ٸ�Ba(OH)2��Һ�����ʵ���Ũ��Ϊ________
�ڼ�ˮϡ��100����������Һ����ˮ�����c(OH��)��____________
����ijŨ��������Һ�������(������֮��)1 : 9��Ϻ�������ҺpH��11����������Һ��pH��________��
��4���ش�������������Ʒ�Ӧ���й�����
�ٽ�����������ʵ���Ũ�ȵĴ��������������Һ��Ϻ���Һ�� (����ԡ��������ԡ����ԡ�����ͬ)����Һ��c(Na��) c(CH3COO��)(� >�� ���� ��<�� )��
��pH��3�Ĵ����pH��11������������Һ�������Ϻ���Һ�� ����Һ��c(Na��)
c(CH3COO��) .
�����ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ�д�������Ӻ�������Ũ����ȣ����Ϻ���Һ�� ��������� ����������Һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��14�֣�ͼa��1 mol NO2��1 mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ��ͼb�Ƿ�Ӧ�е�CO��NO��Ũ����ʱ��仯��ʾ��ͼ����������ش���������
��1��д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ ��
��2���ӷ�Ӧ��ʼ��ƽ�⣬��NO2Ũ�ȱ仯��ʾƽ����Ӧ����v(NO2)�� ��
��3�����¶��¸÷�Ӧ��ƽ�ⳣ��K= ���¶Ƚ��ͣ�K ����������С�����䡱��
��4�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
| �� �� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2��1 mol CO 1 mol NO��1 mol CO2 |
| ƽ��ʱc(NO) /mol��L-1 | 1.5 | 3 | m |
| �����仯 | �ų�a kJ | ����b kJ | �ų�c kJ |
| CO��NO��ת���� | ��1 | ��2 | ��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(10��)��ѧ���������кܶ��Ӧ�ã�����������ڿ�������������ˮ��������ҵ���ﴦ������ΪƯ���ȣ�������(Si3N4)��һ�������մɲ��ϣ����нϸߵ�Ӳ�������¡�
��1���������������������ҿ������������е��ʷ�Ӧ����֪��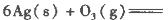
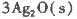 ��Ӧ����3 mol Ag2O(s)ʱ�ų�������Ϊ
��Ӧ����3 mol Ag2O(s)ʱ�ų�������Ϊ
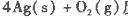 ��Ӧ����4 mol Ag(s)ʱ���յ�����Ϊ62��2 kJ���Ը�����������ж�O3ת��ΪO2��________������ȡ������ȡ�����Ӧ��
��Ӧ����4 mol Ag(s)ʱ���յ�����Ϊ62��2 kJ���Ը�����������ж�O3ת��ΪO2��________������ȡ������ȡ�����Ӧ��
��2��������()����ʯӢ�뽹̿�ڸ��µ���������ͨ�����·�Ӧ�Ƶã�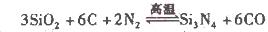
��VL���ܱ������н��з�Ӧ��ʵ���������±�: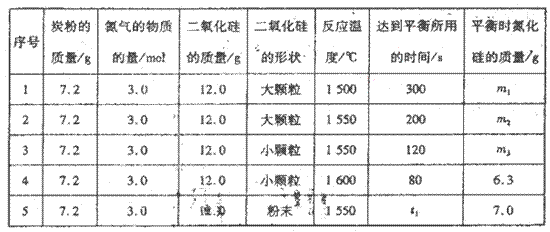
��ʵ��l��ʵ��2������________�Է�Ӧ������Ӱ�죬��ͬһ�����о���ʵ�黹��һ����________����ʵ����ţ�����ʵ�黹�о���_______�Է�Ӧ���ʵ�Ӱ�졣��
��ʵ��5�У�t1________(�>������<����=��)120��ƽ��ʱ�����������ת����Ϊ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪��ϡ��Һ�У�ǿ����ǿ�Ӧ�к��ȵ���ֵΪ57.3kJ/mol��
��1����0.1molBa(OH)2��ɵ�ϡ��Һ��������ϡ���ᷴӦ���ų�______kJ������
��2��1L0.1mol/LNaOH��Һ�ֱ���ٴ�����Һ��Ũ�����ϡ����ǡ�÷�Ӧʱ���ų��������ֱ�ΪQ1��Q2��Q3����λ��kJ�����������ɴ�С��˳����_________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����ѧ����ѡ��2����ѧ�뼼������15�֣�
������������ʼ��仯�����ڹ�ҵ���й㷺Ӧ�á�
��1��ͬ��ʯ�ڸ������Ʊ������Ȼ�ѧ����ʽΪ��
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) 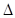 H
H
��֪��ͬ�����£�
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ��H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ��H2
SiO2(s)+CaO(s)=CaSiO3(s) ��H3
�á�H1����H2�͡�H3��ʾ H����
H���� H= ��
H= ��
��2�������������Ϊ����������ӣ�����ṹʽ��ͼ��֮����ȥ��
��ˮ���Ӳ����ṹʽΪ ������
�����ƣ��׳ơ����ơ����dz��õ�ˮ���������仯ѧʽΪ ��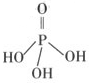
��3���������ƣ�NaH2PO2�������ڹ�ҵ�ϵĻ�ѧ������
�ٻ�ѧ��������Һ�к���Ni2+��H2PO2���������Ե������·���������Ӧ��
��a�� Ni2+ + H2PO2��+ �� Ni++ H2PO3��+
��b��6H2PO-2 +2H+ =2P+4H2PO3+3H2�� ���ڴ����д������ƽ��Ӧʽ��a����
���ڴ����д������ƽ��Ӧʽ��a����
�����â��з�Ӧ�������϶Ƽ�������������Ͻ𣬴Ӷ��ﵽ��ѧ������Ŀ�ģ�����һ�ֳ����Ļ�ѧ�ơ�������·���Ƚϻ�ѧ�����ơ�
�����ϵIJ�ͬ�㣺 ��
ԭ���ϵIJ�ͬ�㣺 ��
��ѧ�Ƶ��ŵ㣺 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)ij��Ӧ�����е������仯��ͼ��ʾ��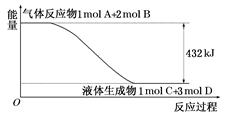
д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
(2)0.3 mol��̬����ȼ��������(B2H6)��������ȼ�գ����ɹ�̬�����������Һ̬ˮ���ų�649.5 kJ�����������Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com