
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 食盐熔化 | D. | 电解水生成氢气和氧气 |
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);
(1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>HClO4 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油能使溴的四氯化碳溶液褪色 | |
| B. | 蛋白质、纤维素、油脂、淀粉都是高分子化合物 | |
| C. | 石油裂化、煤的干馏、铝热反应都属于化学变化 | |
| D. | 乙烯常用作水果催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯乙烷制备乙醇 | B. | 石油裂解制丙烯 | ||
| C. | 乙醇与乙酸反应制乙酸乙酯 | D. | 油脂与浓NaOH反应制高级脂肪酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
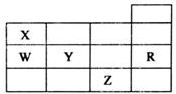 五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )
五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )| A. | W的简单氢化物的沸点比X的简单氢化物的沸点低 | |
| B. | 五种元素均在元素周期表的s区 | |
| C. | 电负性和第一电离能均为:Y>X>W | |
| D. | 五种元素的单质所形成的晶体类型不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com