
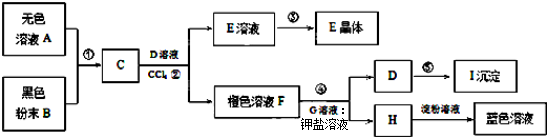
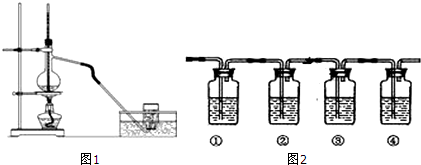
分析 C与D反应反应后,加入四氯化碳得到橙色溶液F,分液得到F为Br2的四氯化碳溶液与E水溶液,H遇淀粉溶液呈蓝色溶液,则H为I2,G为钾盐溶液,而F与G反应得到D与H,则G为KI,D为KBr,KBr经过反应⑤得到沉淀I,应与硝酸酸化的硝酸银反应,沉淀I为AgBr.C与KBr反应得到F为Br2,故E为KCl,蒸发E溶液得到E晶体,据此解答.
解答 解:C与D反应反应后,加入四氯化碳得到橙色溶液F,分液得到F为Br2的四氯化碳溶液与E水溶液,H遇淀粉溶液呈蓝色溶液,则H为I2,G为钾盐溶液,而F与G反应得到D与H,则G为KI,D为KBr,KBr经过反应⑤得到沉淀I,应与硝酸酸化的硝酸银反应,沉淀I为AgBr.C与KBr反应得到F为Br2,故E为KCl,蒸发E溶液得到E晶体.
(1)溶液E、F为互不相溶的液体,分离溶液E、F的实验操作②为分液,实验操作③是从水溶液中获得固体,应是蒸发结晶,
故答案为:分液;蒸发结晶;
(2)实验操作⑤是KBr与硝酸酸化的硝酸银溶液反应,生成的沉淀I为AgBr,常用作感光材料,
故答案为:HNO3、AgNO3;制作感光材料;
(3)反应④是Br2与KI反应生成KBr、I2,化学反应方程式为:Br2+2KI=2KBr+I2,
故答案为:Br2+2KI=2KBr+I2;
(4)反应①为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氧化剂为MnO2,氧化产物为Cl2,
反应②为:Cl2+2KBr=2KCl+Br2,氧化剂为Cl2,氧化产物为Br2,
反应④为:Br2+2KI=2KBr+I2,氧化剂为Br2,氧化产物为I2,
氧化剂氧化性强于氧化产物的氧化性,共有氧化性:MnO2>Cl2>Br2>I2,
故答案为:MnO2>Cl2>Br2>I2.
点评 本题考查无机物推断、物质的分离提纯、氧化性比较等,特殊反应现象为推断突破口,需要学生具备扎实的基础,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素X与氢形成的原子比为1:1的化合物有很多种 | |
| B. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
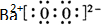 (写电子式),
(写电子式),查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:实验题
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
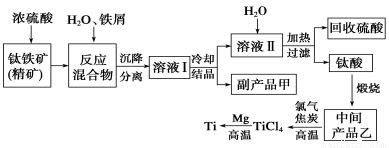
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲阳离子是________。
(2)上述生产流程中加入铁屑的目的是____________________________。
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol·L-1,当溶液的pH等于________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:________________________。
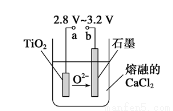
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是__________________。(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图所示。下图中b是电源的________极,阴极的电极反应式________。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
关于常温下pH=2的醋酸,下列叙述正确的是
A.c(CH3COOH)=0.01mol·L-1
B.c(H+)=c(CH3COO-)
C.加水稀释100倍后,溶 液pH=4
液pH=4
D.加入CH3COONa固体,可抑制CH3COOH的电离
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
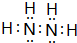 ,六个原子处在同一平面吗?否(是?否?).
,六个原子处在同一平面吗?否(是?否?).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | 金属钠和水的反应:Na+2H2O=H2↑+Na++2OH- | |
| C. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+=Al3++3H2O | |
| D. | Ba(OH)2溶液中加入稀H2SO4:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com