
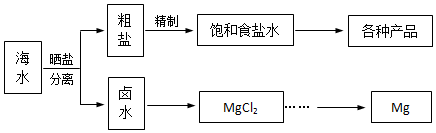
分析 (1)把杂质转化为沉淀或气体除去,除钙离子用碳酸根,除镁离子用氢氧根,除Fe3+用氢氧根,除硫酸根用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉;
(2)①空气中的二氧化碳和水蒸气均能与过氧化钠反应,须先除去空气中的二氧化碳与水蒸气;钠和氧气缓慢氧化生成氧化钠;
②根据反应物、产物写出相应的电解方程式,根据方程式进行计算;
③由题意可知电解氯化钠溶液生成次氯酸钠和氢气;
(3)①从图中可看出将Fe2+、Fe3+、Mn2+转化为沉淀除去,PH最低应该为9.5,PH=10时Mg2+开始沉淀;
②MgCl2易水解生成HCl,升高温度促进水解得到水解产物,抑制水解需要在酸性环境中加热失去结晶水.
解答 解:除去粗盐中的可溶性杂质:Mg2+、Ca2+、Fe3+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序;然后调节溶液的pH等于7后蒸发即可,正确的操作顺序是:⑤③②①⑥④⑦,
故答案为:D;
(2)①空气中的二氧化碳和水蒸气均能与过氧化钠反应,必须先除去空气中的二氧化碳与水蒸气,在通入到容器中和金属钠反应;钠在温度较低时可以和氧气缓慢氧化成氧化钠;
故答案为:防止过氧化钠与空气中的二氧化碳和水蒸汽反应;Na2O;
②因电解饱和食盐水的方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,当产生的H2的体积为112mL即0.005mol时,生成氢氧化钠的物质的量为0.01mol,所以溶液中NaOH的物质的量浓度=$\frac{0.01mol}{0.1L}$═0.1mol/L,所以氢离子的浓度为$\frac{1×1{0}^{-14}}{0.1}$=1×10-13mol/L,PH=13;
故答案为:13;
③根据题意可知,氯气和氢氧化钠溶液反应生成物中只有一种溶质,所以该溶质是偏铝酸钠,则反应的化学方程式是NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑;
故答案为:NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑;
(3)①从图中可看出将Fe2+、Fe3+、Mn2+转化为沉淀除去,PH最低应该为9.5,PH=10.0时Mg2+开始沉淀,所以PH值最大应小于10.0;
故答案为:9.5≤PH<10.0;
②MgCl2易水解生成HCl和氢氧化镁,为防止水解,应该将MgCl2•6H2O放在HCl范围中加热,
故答案为:在HCl气流中加热脱结晶水.
点评 本题考查较为综合,涉及物质分离提纯、电解等知识,题目综合度较高,题目难度中等,学习中注重相关基础知识的积累.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:解答题
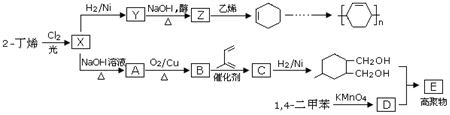
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 283kJ•mol-1 | B. | +172.5 kJ•mol-1 | C. | -172.5 kJ•mol-1 | D. | -504 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液 | |
| B. | 将纳米材料(微粒直径是1nm-100nm)分散到分散剂中得到的分散系有丁达尔效应 | |
| C. | 氢氧化铁胶体的制备方法是:将氢氧化铁固体溶于沸水中继续煮沸 | |
| D. | 胶体与其它分散系的本质区别是胶体的分散质粒子的微粒直径在1nm-100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2 $\stackrel{光}{→}$ CH3Cl+HCl | |
| B. | CH2═CH2+HBr-→CH3CH2Br | |
| C. | CH3COOH+CH3CH2OH$→_{△}^{H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯碱溶液溶解苯酚:CO32-+C6H5OH→C6H5O-+HCO3- | |
| B. | 用强碱溶液吸收工业制取硝酸尾气NO+NO2+2OH-=2NO3-+H2O | |
| C. | 用二氧化锰和浓盐酸反应制氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 向AlCl3溶液中滴加过量的氨水:Al3++4NH3•H2O=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

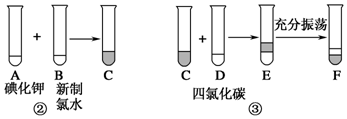
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Ⅰ达到平衡时,A、B、C各增加1mol,则B的转化率一定增大 | |
| B. | 若向平衡Ⅰ中再加入6mol A,4mol B.测得C的体积分数大于a,可断定x>4 | |
| C. | 若x=2,则体系Ⅱ起始物质的量应满足:3n(B)=n(A)+3 | |
| D. | 若体系Ⅱ起始物质的量满足3n(c)+4n(A)=12n(B),则可推断:x=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com