
 由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.
由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症. ,未成对电子数为5.
,未成对电子数为5.分析 (1)①配合物Na2[Fe(CN)5(NO)]的中心离子为铁离子,铁离子的价层电子排布为3d5;
②配合物Na2[Fe(CN)5(NO)]中内界与外界之间是离子键,配体与中心离子间是配位键,配体内部碳氮之间及氮氧之间是极性共价键;
③同一周期元素的第一电离能随着原子序数的增大而呈增大趋势,氮元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
由C、N、O中两种元素组合可构成原子个数比为1:3的常见微粒为NO3-;
④CN-含有2个原子、价电子总数为10,与CN-互为等电子体的单质为N2,N2分子中N原子形成一个σ键、含有1对孤对电子,杂化轨道数为2;
(2)Ni(CO)4为无色挥发性液态物质,熔沸点低,属于分子晶体;根据相似相溶原理分析溶解性;
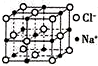
(3)根据NaCl的晶胞结构可知,每个晶胞中含有4个钠离子和4个氯离子,所以NaCN的晶胞也含有4个钠离子和4个氰根离子,表示出晶胞质量,结合m=ρV计算晶胞的体积,进而计算晶胞的边长.
解答 解:(1)①配合物Na2[Fe(CN)5(NO)]的中心离子为铁离子,铁离子的价层电子排布为3d5,价电子排布图为 ,有5个未成对的电子,
,有5个未成对的电子,
故答案为: ;5;
;5;
②配合物Na2[Fe(CN)5(NO)]中内界与外界之间是离子键,配体与中心离子间是配位键,配体内部碳氮之间及氮氧之间是极性共价键,不存在的是金属键和分子间作用力,
故选:be;
③同一周期元素的第一电离能随着原子序数的增大而呈增大趋势,氮元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,所以其第一电离能大小顺序是C<O<N,
由C、N、O中两种元素组合可构成原子个数比为1:3的常见微粒为NO3-,N原子孤电子对数为$\frac{5+1-2×3}{2}$=0,价层电子对数为3+0=3,故空间构型为平面三角形,
故答案为:C<O<N;平面三角形;
④CN-含有2个原子、价电子总数为10,与CN-互为等电子体的单质为N2,N2的结构式为N≡N,N2分子中N原子形成一个σ键、含有1对孤对电子,杂化轨道数为2,所以杂化方式为sp杂化,
故答案为:N≡N;sp;
(2)Ni(CO)4为无色挥发性液态物质,熔沸点低,属于分子晶体,呈正四面体构型,是对称结构,所以是非极性物质,根据相似相溶原理知,Ni(CO)4 易溶于非极性溶剂,苯、四氯化碳是非极性物质,所以Ni(CO)4 易溶于苯、四氯化碳,故选bc,
故答案为:分子晶体;bc;
(3)根据NaCl的晶胞结构可知,每个晶胞中含有4个钠离子和4个氯离子,所以NaCN的晶胞也含有4个钠离子和4个氰根离子,则晶胞质量为$\frac{4×49}{{N}_{A}}$g,晶体的密度为ρ g.cm-3,晶胞的体积为$\frac{4×49}{{N}_{A}}$g÷ρ g.cm-3=$\frac{196}{ρ{N}_{A}}$cm3,所以晶胞的边长为$\root{3}{\frac{196}{ρ{N}_{A}}}$cm,
故答案为:$\root{3}{\frac{196}{ρ{N}_{A}}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、空间构型与杂化发生判断、电离能、等电子体、化学键、晶体类型与性质、晶胞的计算等知识点,注意同周期主族元素中第一电离能异常情况.


 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH2Cl | B. | CH3CH2CHClCH2CH3 | ||
| C. | 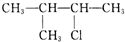 | D. | 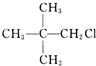 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量氯化钴晶体溶于一定浓度的盐酸溶液呈紫色,加热后溶液颜色变成蓝色 | |
| B. | 中和热测定实验中,环形玻璃搅拌棒不能用铜质搅拌棒代替 | |
| C. | 容量瓶、分液漏斗、滴定管使用时都必须检查是否漏水 | |
| D. | 滴定管水洗后必须烘干才能使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
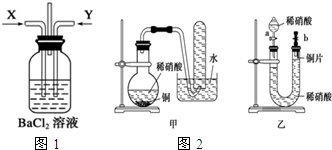 请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
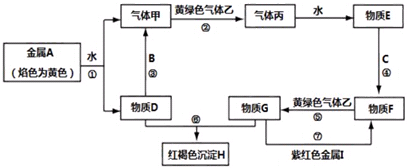
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚不慎沾到皮肤上,要先用氢氧化钠溶液清洗,再用水洗 | |
| B. | 被蜜蜂或者蚂蚁蛰了以后痛痒难忍,可以用稀硼酸溶液清洗被蛰处,可减轻痛痒 | |
| C. | 浓硝酸不慎滴到皮肤上,皮肤变成黄色,是因为发生了颜色反应 | |
| D. | 甘油和乙二醇都可以用做抗冻剂,是因为这两个物质的凝固点比较低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com