


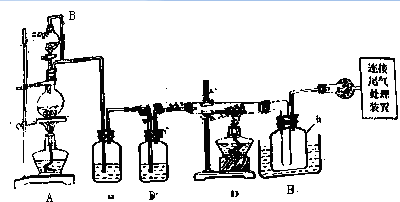
分析 (1)冷凝管起冷凝回流的作用,注意冷却水的进出口位置;
(2)油浴加热受热均匀,便于控制温度,且装置中温度计可以改变位置,只要在反应体系中即可;
(3)温度越高,氨基苯磺酸的溶解度越大,易于损失;
(4)将“粗产品用沸水溶解,冷却结晶,过滤”的操作进行多次,过多的除去杂质,从而提高对氨基苯磺酸纯度;过滤液中含有对氨基苯磺酸,对滤液收集处理能减少损失.
解答 解:(1)冷凝管起冷凝回流的作用,冷却水从下口进入、上口出来,能防止馏分温度急剧降低而炸裂冷凝管,故答案为:冷凝回流;
(2)A.油是液体,加热时油受热均匀,导致三颈烧瓶内反应物受热均匀,从而便于控制温度,故正确;
B.该反应温度需要170~180℃,沸水的温度最高100℃,所以温度达不到要求,则不能改为水浴加热,故错误;
C.实验装置中的温度计可以改变位置,只要在反应体系中即可,所以也可使其水银球浸入在油中,故正确;
故选AC;
(3)100mL水在20℃时可溶解对氨基苯磺酸1.08g,在100℃时可溶解6.67g,由此得知,温度越高,对氨基苯磺酸溶解度越大,为减少对氨基苯磺酸的损失,应该降低温度,所以用冷水洗涤晶体,
故答案为:减少对氨基苯磺酸的损失;
(4)溶剂质量越大,溶解的杂质越多,将“粗产品用沸水溶解,冷却结晶,过滤”的操作进行多次,可以过多的除去杂质,从而提高对氨基苯磺酸纯度;过滤液中含有对氨基苯磺酸,如果不对滤液进行处理,对导致部分对氨基苯磺酸损失,对滤液收集处理能减少损失,
故答案为:提高对氨基苯磺酸的纯度;提高对氨基苯磺酸的产率.
点评 本题考查有机物的制备,明确实验操作步骤及每一步操作目的是解本题关键,侧重考查学生分析、知识运用能力,熟练掌握常见基本操作规范,防止安全事故发生.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
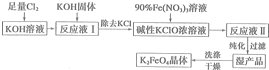

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

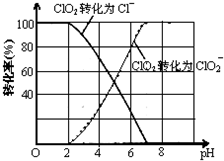
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | | 315 | |
| 熔点/℃ | -70.0 | -107.2 | | | |
| 升华温度/℃ | 180 | 300 | 162 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤族单质,随着相对分子量的增大,分子间作用力增强,熔沸点也相应升高 | |
| B. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| C. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| D. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com