
有关元素X、Y、Z、D、E的信息如下:
元素 | 有关信息 |
X | 元素主要化合价-2,原子半径为0.0074 nm |
Y | 所在主族序数与所在周期序数之差为4 |
Z | 单质在X的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
D | 最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子 |
E | 单质是生活中的常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题(用化学用语表示):
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为____________。
(2)比较Y与Z的氢化物的稳定性________(用化学式表示)。
(3)E元素与Y元素可形成EY2和EY3两种化合物,则下列说法中正确的是________(填序号)
①通常实验室配制EY3溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25 mol该物质与一定量的水混合得到一种稀溶液时,放出Q kJ的热量,写出该反应的热化学方程式_______________________________。
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式_____________________。
科目:高中化学 来源:2015-2016学年黑龙江省高一下期末化学试卷(解析版) 题型:选择题
下列反应中,光照对反应几乎没有影响的是( )
A. 氯气与氢气的反应
B. 氯气与甲 烷的反应
烷的反应
C.氧气与甲烷的反应
D. 次氯酸的分解
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一下期末文科化学试卷(解析版) 题型:选择题
影响金属冶炼方法的主要因素是( )
A.金属的活动性大小
B.金属在地壳中的含量多少
C.金属的化合价高低
D.金属的导电性强弱
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一下期末理科化学试卷(解析版) 题型:选择题
把下列四种X溶液分别加入四个盛有10mL2mol/L盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸缓缓地进行反应.其中反应速率最大的是( )
A.10℃,20mL3mol/L的X溶液 B.50℃20mL3mol/L的X溶液
C.50℃ 10mL4mol/L的X溶液 D.10℃10mL2mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一下期末理科化学试卷(解析版) 题型:选择题
不能说明氧的非金属性比硫强的事实是( )
A.H2O的热稳定性强于H2S
B.硫化氢水溶液露置于空气中变浑浊
C.H2O是液体,H2S常温下是气体
D.氧气和氢气化合比硫和氢气化合容易
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一下期末化学试卷(解析版) 题型:填空题
X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的一种单质是自然界硬度最大的晶体 |
Y | Y的基态原子最外层电子排布式为nsnnpn+1 |
Z | Z的基态原子L层电子数是K层电子数的3倍 |
W | W的一种核素的质量数为58,中子数为32 |
(1)Y位于元素周期表第 周期第 族;Y和Z的氢化物稳定性顺序为: > (写化学式)。
(2)X、Y、Z的第一电离能由大到小的顺序为 ;W的基态原子核外电子排布式是 。
(3)向W单质与盐酸反应后的溶液中通入过量Y的气态氢化物,能观察到的现象是 ,发生反应的化学方程式是 。
(4)已知Y的氢化物在催化加热的条件下,可以与Z2发生氧化还原反应,并且在室温下每转移10mol电子放热akJ,该反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一下期末化学试卷(解析版) 题型:简答题
把滤纸用淀粉和碘化钾的溶液浸泡,晾干后就是实验室常用的淀粉碘化钾试纸,这种试纸润湿后遇到氯气会发生什么变化?为什么?
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省宿迁市高二下学期期末化学试卷(解析版) 题型:填空题
综合利用CO2、CO对构建低碳社会有重要意义。
(1)利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g) CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
①10min后达到平衡时CO的浓度为 ;
②10min内用H2表示的平均反应速率为 ;
③若要加快CH3OH的生成速率,可采取的措施有 (填一种合理的措施)
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2 CH2=CH2+4H2O
CH2=CH2+4H2O
①已知:4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,
写出该反应的热化学方程式 。
②不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。

下列有关说法不正确的是 (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
③若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高二下学期期末化学试卷(解析版) 题型:选择题
2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
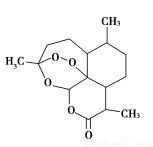
A.青蒿素分子式为C15H22O5
B.青蒿素易溶于乙醇、苯
C.青蒿素因含有—O—(醚键)而具有较强的氧化性
D.青蒿素在碱性条件下易发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com