
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
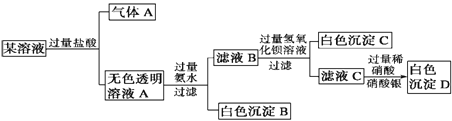
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
【答案】C
【解析】
该溶液中加入过量盐酸,有气体A生成,推出原溶液中含有CO32-,根据离子共存,原溶液中一定没有Cu2+、Ba2+、Fe3+,根据溶液呈现电中性,则原溶液中一定有Na+,无色透明溶液A中加入过量氨水,得到白色沉淀,白色沉淀为Al(OH)3,则原溶液中一定含有AlO2-,滤液B中加入过量的氢氧化钡溶液,有白色沉淀,白色沉淀为BaSO4,则原溶液中含有SO42-,滤液C中加入过量的稀硝酸酸化的硝酸银,出现白色沉淀,沉淀为AgCl,Cl-来自于过量的盐酸,原溶液中不能确认是否含有Cl-。
该溶液中加入过量盐酸,有气体A生成,推出原溶液中含有CO32-,根据离子共存,原溶液中一定没有Cu2+、Ba2+、Fe3+,根据溶液呈现电中性,则原溶液中一定有Na+,无色透明溶液A中加入过量氨水,得到白色沉淀,白色沉淀为Al(OH)3,则原溶液中一定含有AlO2-,滤液B中加入过量的氢氧化钡溶液,有白色沉淀,白色沉淀为BaSO4,则原溶液中含有SO42-,滤液C中加入过量的稀硝酸酸化的硝酸银,出现白色沉淀,沉淀为AgCl,Cl-可能来自于过量的盐酸,不能确认原溶液中是否含有Cl-。
A、原溶液中一定存在Na+、AlO2-、CO32-、SO42-,故A错误;
B、根据上述分析,气体为CO2,故B错误;
C、原溶液中一定不存在的离子是Cu2+、Fe3+、Ba2+,故C正确;
D、NH3·H2O为弱碱,离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,故D错误。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.对同类事物进行再分类可用树状分类法
B.对某物质的分类不可能有多个标准
C.试管、烧杯和容量瓶都可以直接用来加热
D.分液是提纯或分离几种互溶且沸点不同的液体混合物的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2, 所得溶液 pH 变化如图所示。下列分析中,正确的是( )

A. ab 段反应是:SO2+ 2 H2S="3S↓+2" H2O
B. 亚硫酸是比氢硫酸更弱的酸
C. 原H2S溶液的物质的量浓度为0.05 molL-1
D. b 点对应的溶液导电性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将12.8g铜片加入到100ml一定浓度的硝酸溶液中,铜片完全溶解,产生NO和NO2的混合气体4.48L(标准状况下);若向反应后的溶液中加入400ml、2mol/L NaOH溶液,能使溶液中的Cu2+恰好完全沉淀。下列说法不正确的是
A. 反应后溶液中剩余NO3-的物质的量为0.4mol
B. 原硝酸溶液的物质的量浓度为10mol/L
C. 铜片与硝酸反应过程中转移电子0.4mol
D. 混合气体中NO和NO2的体积之比为1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:
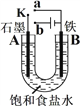
(1) 若开始时开关K与a连接,则A极的电极反应式为______________________________。
(2) 若开始时开关K与b连接,总反应的离子方程式为________________________________。
(3) 有关上述实验(2)的下列说法,正确的是(填序号)_________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4) 该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
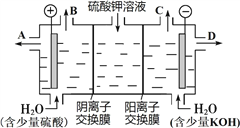
①该电解槽的阳极反应式为____________________________。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或“D”)______导出。
③若将甲醇和氢氧化钾溶液组合为甲醇燃料电池,则电池负极的电极反应式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过膜电池可除去废水中的乙酸钠和对氯笨酚(![]() ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是

A. B为电池的正极,发生还原反应
B. 电流方向从B极沿导线经小灯泡流向A极
C. A极的电极反应式为:![]()
D. 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的铁粉在氯气中充分燃烧,将所得固体完全溶解于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是___________________________________________。
(2)推测A中可能含有的金属阳离子:①只有Fe3+;②只有Fe2+;③____________________________________。甲同学为探究溶液的组成,实验如下:
实验步骤 | 实验现象 | 实验结论及反应的离子方程式 |
取少量溶液A于试管中,加入KSCN溶液 | ________________ | 假设②不成立,假设①或③成立;反应的离子方程式是________________ |
(3)乙同学继续探究溶液A的组成。
查阅资料:16HCl+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:另取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4溶液紫色褪去,实验结论:________(填字母序号)。
a.可能有Fe2+ b.可能无Fe2+ c.一定有Fe2+
根据你选择的实验结论,简述理由:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.高铁酸钾( K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图是高铁电池的模拟实验装置:
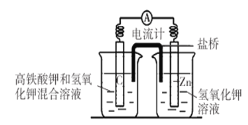
(1)该电池放电时正极的电极反应式为_________________________________________;若维持电流强度为1A,电池工作十分钟,理论消耗Zn_______g(已知F=96500C/mol,小数点后保留1位)。
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向_______移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向_______移动(填“左”或“右”)。
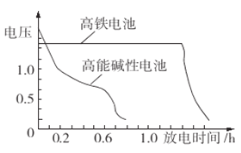
(3)下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有____。
Ⅱ.工业上湿法制备K2FeO4的工艺流程如图。
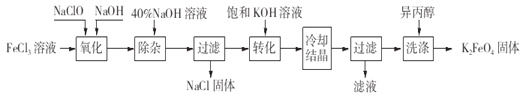
(4)完成“氧化”过程中反应的化学方程式:___FeCl3+___NaOH+___NaClO=___Na2FeO4+___NaCl+___H2O,其中氧化剂是_______(填化学式)。
(5)加入饱和KOH溶液的目的是_____________________。
(6)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入_______mL 2 mol/L的盐酸(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化铬的水合物为CrCl3·6H2O,其中铬元素的配位数是6,将含0.1 mol氯化铬的水溶液用过量稀硝酸银溶液处理时,只得到0.2 mol AgCl沉淀,则氯化铬溶于水中的含铬阳离子为
A. Cr3+B. [CrCl2(H2O)4]+C. [CrCl(H2O)5]2+D. [Cr(H2O)6]3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com