
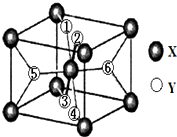
 在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物.氢化物晶体的结构有共价型和离子型之分.分析 (1)①Cu原子核外有29个电子,再根据核外电子排布规律来写;
②氨水溶液中含N、O、H三种元素,氢的电负性最小,同周期自左而右电负性增大;
③甲基(-CH3)中原子形成4个单键,杂化轨道数目为4,羧基(-COOH)中碳原子形成3个σ键,杂化轨道数目为3;
④[Cu(NH3)3CO]Ac中配离子与醋酸根之间形成离子键,配离子中铜离子与氨气分子、CO分子之间形成配位键,氨气分子中为N-H键,醋酸根中含有单键、C=O双键,CO含有C≡O三键;
(2)①根据均摊法,X为8个顶点加一个体心,晶胞中一共含2个X,则由氢化物化学式为XY2,则该晶胞中含4个Y,又1、2、3、4号Y原子在晶胞上、下面上,则实际为2个Y原子,故5、6号Y原子均在晶胞内部;
②XY2晶体为离子晶体,硅烷晶体和固态氨为分子晶体,氨存在分子间氢键,沸点高于硅烷.
解答 解:(1)①Cu元素为29号元素,原子核外有29个电子,所以外围电子排布式为:3d104s1,故答案为:3d104s1;
②氨水溶液中含N、O、H三种元素,氢的电负性最小,又同周期自左而右电负性增大,故负性从大到小的排列顺序为O>N>H,故答案为:O>N>H;
③甲基(-CH3)中原子形成4个单键,杂化轨道数目为4,采用sp3杂化,羧基(-COOH)中碳原子形成3个σ键,杂化轨道数目为3,采用sp2杂化,故答案为:sp3;sp2 ;
④Cu2+与NH3存在配位键,NH3中N与H形成σ键,[Cu(NH3)3CO]+与Ac-之间是离子键,Ac-内有碳氧双键,所以还有π键,即存在的化学键类型为:配位键、σ键、π键和离子键,故选:abcd;
(2)①X为8个顶点加一个体心,晶胞中一共含2个X,则由氢化物化学式为XY2,则该晶胞中含4个Y,又1、2、3、4号Y原子在晶胞上、下面上,则实际为2个Y原子,则5、6号Y原子均在晶胞内部,故答案为:内部;
②XY2晶体为离子晶体、硅烷晶体和固态氨为分子晶体,所以XY2晶体最高,而固态氨存在分子间氢键,所以固态氨的熔沸点比硅烷晶体高,故选:b.
点评 本题是对物质结构与性质的考查,涉及核外电子排布式、电负性、杂化类型的判断、化学键、晶体类型与性质、晶胞的计算等知识,是对所学知识的综合考查与运用,难度中等.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 燃烧汽油产生的汽车尾气中所含的大气污染物主要是CO,NO、SO2、CO2等 | |
| B. | 乙醇、次氯酸钠溶液均可以将病毒氧化而消毒 | |
| C. | 用纯碱溶液清洗餐具上的油污时,加热可以提高去污能力 | |
| D. | 火力发电是将化学能直接转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cr最外层电子排布式 4s2 | B. | 乙醇的结构简式CH3CH2OH | ||
| C. | 二氧化硅的分子式 SiO2 | D. | 甲醛的电子式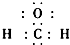 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
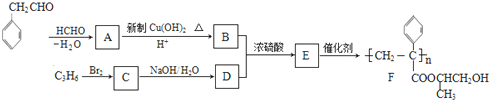
 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$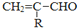
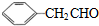 的相对分子质量大2,则符合下列条件的G的同分异构体有3种.
的相对分子质量大2,则符合下列条件的G的同分异构体有3种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
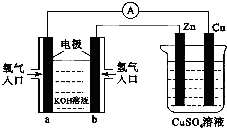
| A. | 该装置中Cu极为正极 | |
| B. | 当铜极的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L | |
| C. | b极反应的电极反应式为:H2-2e-═2H+ | |
| D. | 一段时间后锌片质量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钙原子的结构示意图: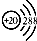 | |
| B. | 结构简式为CH2CH2的分子可发生加成反应 | |
| C. | 符号为${\;}_{8}^{18}$O的原子常用于文物年代的测定 | |
| D. | 电子式分别为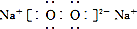 和 和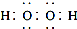 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一块铝片投入足量NaOH溶液中,充分反应后铝片消失,将溶液蒸干便可得到纯净NaAlO2 | |
| B. | 将二块相同铝片投入到等物质的量浓度的CuSO4和CuCl2溶液中,反应速率几乎相同 | |
| C. | 将铝粉投入浓NaOH溶液中,1mol铝可还原3mol水 | |
| D. | 将一小块钠投入盛有乙醇的烧杯中,由于钠的密度大于乙醇,所以钠一直在液面下反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com