
| A. | 甲溶液含有OH- | B. | 乙溶液含有SO42- | C. | 丙溶液含有Cl- | D. | 丁溶液含有Mg2+ |
分析 ①将甲溶液分别与其他三种物质的溶液混合,可以形成白色沉淀的只有BaSO4、BaCO3、Mg(OH)2,则甲只能是Ba(OH)2;
②0.1mol/L乙溶液中c(H+)>0.1mol/L,说明乙是硫酸;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成,说明丙是MgCl2,则丁是NH4HCO3,以此来解答.
解答 解:由②中的信息可知乙是二元酸,故乙是H2SO4;由③中现象,可以推知丙中含有Cl-;再结合①中提供信息,甲与其它三种物质混合均产生白色沉淀,
则可推出:甲是Ba(OH)2,乙是H2SO4,丙是MgCl2,丁是NH4HCO3,
A.甲是Ba(OH)2,则碱溶液中含有OH-离子,故A正确;
B.乙是H2SO4,则乙溶液中含有氢离子,故B正确;
C.丙是MgCl2,丙溶液含有Cl-,故C正确;
D.丁是NH4HCO3,则丁中不含有Mg2+,故D错误;
故选D.
点评 本题考查离子的推断,为高频考点,把握离子之间的反应与现象为解答的关键,侧重分析与推断能力的考查,注意乙为硫酸、甲为氢氧化钡为突破口,题目难度不大.


科目:高中化学 来源: 题型:实验题
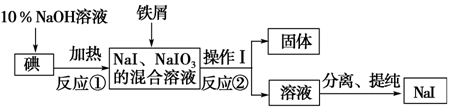
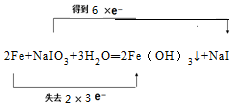 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂可以提高单位时间氨的产量 | |
| B. | 高压有利于氨的合成反应 | |
| C. | 500℃高温比室温更有利于合成氨的反应 | |
| D. | 恒温恒容下,在合成氨平衡体系中充入He,使压强增大,则平衡正向移动,NH3增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
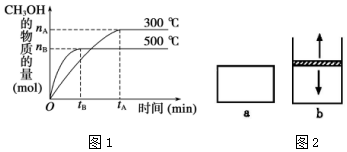 一定条件下,在体积为 3L 的密闭容器中反应 CO(g)+2H2(g)?CH3OH(g)△H=akJ•mol-1,△S=b J•mol-1•K-1(a、b 均为正数),达到化学平衡状态.
一定条件下,在体积为 3L 的密闭容器中反应 CO(g)+2H2(g)?CH3OH(g)△H=akJ•mol-1,△S=b J•mol-1•K-1(a、b 均为正数),达到化学平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(2Q1-2Q2+Q3) kJ•mol-1 | |
| B. | S(s)+2CO(g)═SO2(g)+2C(s)△H=(Q1-Q3) kJ•mol-1 | |
| C. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(Q1-2Q2+Q3) kJ•mol-1 | |
| D. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(2Q1-Q2+2Q3) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol
CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 向稀盐酸溶液中加入铁粉:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| D. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com