

| A. | 按系统命名法命名,图1化合物的名称是2,4,6一三甲基-5-乙基庚烷 | |
| B. | 图2有机物的一种芳香族同分异构体能发生银镜反应 | |
| C. | 图2有机物能使酸性高锰酸钾溶液褪色 | |
| D. | 图3为髙分子化合物,其单体为对苯二甲酸和乙醇 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
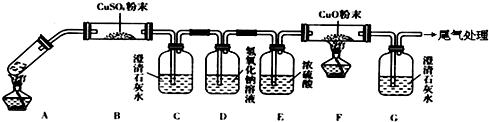
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红外光谱可确定分子内有O-H键、C-H键和C-O键 | |
| B. | 核磁共振氢谱有二个吸收峰 | |
| C. | 乙醇属于电解质 | |
| D. | 根据乙醇燃烧产物的种类可确定乙醇中含有碳、氢、氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②过程中都只发生了物理变化 | |
| B. | 石油主要是由各种烷烃、环烷烃、芳香烃组成的混合物 | |
| C. | 石油的分馏产品中不能得到汽油、柴油 | |
| D. | ③是加成反应,产物名称是1,2-溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量1mol•L-1的盐酸 | B. | 加入几滴CuSO4溶液 | ||
| C. | 加入少量NaNO3溶液 | D. | 加入少量CH3COONa溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将酒精和1 mol/L的硫酸溶液混合,迅速升温到170℃制取乙烯气体 | |
| B. | 在两支分别盛有少量苯和四氯化碳的试管中加碘水后振荡,鉴别苯和四氯化碳 | |
| C. | 酒精与碘水混合并振荡,萃取碘水中的碘 | |
| D. | 在苯中加铁粉后再加溴水并振荡,制取溴苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com