
| A.0.1 mol/L氨水中:c(NH4+) + c(H+) = c(OH-) |
| B.0.1 mol/L的NH4Cl溶液中:c(NH4+) = c(Cl-) |
| C.同为0.1 mol/L的硫酸和氨水等体积混合后:c(NH4+) + 2c(NH3·H2O) = 2c(SO42-) |
| D.pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-) = c(H+) |
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 盐酸体积 | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH =6的溶液一定呈酸性 |
| B.c(H+)水电离产生= c(OH-)水电离产生的溶液一定呈中性 |
| C.使石蕊试液显红色的溶液一定呈酸性 |
| D.强酸和强碱等物质的量混合后溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH等于1的HNO3与pH等于13的Ba(OH)2溶液等体积混合后,溶液pH为7 |
| B.pH等于3的盐酸稀释105倍后,溶液pH接近于7 |
| C.0.01mol/L的CH3COOH溶液pH大于2漂白性 |
D.pH等于10和pH等于12的两种NaOH溶液等体积混合后,溶液中的c(H+)等于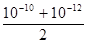 mol/L mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++SO42—。
H++SO42—。| A.c(Na+)=c(SO42—)+c(HSO4—)+c(H2SO4) |
| B.c(OH—)=c(HSO4—)+c(H+) |
| C.c(Na+)+c(H+)=c(OH—)+c(HSO4—)+2c(SO42—) |
| D.c(Na+)="2" c(SO42—)+2 c(HSO4—) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 质未标出)。回答下列问题:
质未标出)。回答下列问题:
 CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:

 极(填“a”或“b”)移动;b电极上发生的反应为 。
极(填“a”或“b”)移动;b电极上发生的反应为 。 达式为 (用m和V1的代数式表示)。
达式为 (用m和V1的代数式表示)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com