
| A. | Na+、Mg2+、SO42-、Cl-不能大量共存,只是因为:Mg2++SO42-═MgSO4↓ | |
| B. | H+、Fe2+、NO3-ClO-不能大量共存,只是因为:H++ClO-═HClO | |
| C. | K+、Ca2+、SiO32-、Cl-不能大量共存,只是因为:Ca2++SiO32-═CaSiO3↓ | |
| D. | Fe3+、NH4+、HCO3-、SCN-不能大量共存,这是因为:Fe3++3SCN-═Fe(SCN)3↓ |
分析 A.该组离子之间不反应;
B.离子之间发生氧化还原反应;
C.离子之间结合生成沉淀;
D.离子之间相互促进水解、离子之间结合生成络离子.
解答 解:A.该组离子之间不反应,可大量共存,故A不选;
B.H+、Fe2+、NO3-(或ClO-)离子之间发生氧化还原反应,不能共存,故B不选;
C.Ca2+、SiO32-结合生成沉淀,不能大量共存,故C选;
D.Fe3+、HCO3-相互促进水解,Fe3+、SCN-结合生成络离子,不能共存,故D不选;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| R | W | ||
| T |
| A. | X有多种同素异形体,而Z不存在同素异形体 | |
| B. | RCl3溶液与Na2W溶液可反应生成一种白色沉淀 | |
| C. | T是一种非金属元素 | |
| D. | 简单离子半径大小关系为W>R>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 醋酸的电离:CH3COOH?CH3COO-+H+ | |
| B. | 碳酸氢钠在水溶液中的电离:NaHCO3?Na++HCO3- | |
| C. | 氯化铵的水解:NH4++H2O?NH4OH+H+ | |
| D. | 碳酸钙的溶解平衡:CaCO3(s)?Ca2+(aq)+CO32-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物分子中的化学键可能含有离子键 | |
| B. | 含有金属元素的化合物-定是离子化合物 | |
| C. | 需要加热才能发生的反应是吸热反应 | |
| D. | 反应是吸热还是放热必须看旧键断裂时吸收的能量和新键生成时释放的能量的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用海水制取氯化钠、烧碱、纯碱、氯气等物质都发生了氧化还原反应 | |
| B. | 蛋白质、葡萄糖、纤维素、油脂等都能在人体内水解并提供能量 | |
| C. | 为了提高生活用水的卫生标准,自来水厂常使用Cl2和CuSO3•5H2O进行消毒、净化、以改善水质 | |
| D. | 塑料、合成橡胶和纤维这三大合成材料,都主要以石油、煤和天然气为原料生产的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
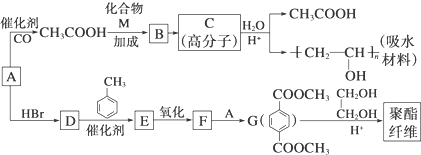
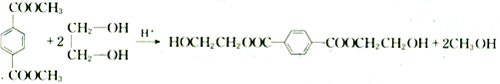 ,
,
 合成
合成 的流程图,(注明反应条件):
的流程图,(注明反应条件): $→_{光照}^{氯气}$
$→_{光照}^{氯气}$ $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$ $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中.
在两支试管中分别加入3mL稀盐酸(均足量),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中.| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2gNa2CO3固体 | 20℃ | 23.3℃ |
| ③ | 35mL稀盐酸 | 含2.5gNaHCO3的 饱和溶液15mL | 20℃ | 18.8℃ |
| ④ | 50mL稀盐酸 | 含3.2gNa2CO3的 饱和溶液15mL | 20℃ | 21.2℃ |
| ⑤ | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 17.4℃ |
| ⑥ | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 24.4℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com