
分析 (1)根据用固体配制一定物质的量浓度溶液一般步骤解答;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;依据配制溶液体积选择合适的容量瓶.
解答 解:(1)用固体配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、移液洗涤、定容摇匀;
故答案为:计算、称量、溶解、移液洗涤、定容摇匀;
(2)用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,用托盘天平称取需要的溶质氯化钠,在烧杯中溶解,用玻璃棒搅拌,冷却至室温后转移到容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.配制1.00mol/L的NaCl溶液0.5L,应选择500mL容量瓶,所以需要的仪器为:托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管,还缺少的仪器:烧杯、玻璃棒、胶头滴管;
故答案为:500mL;烧杯、玻璃棒、胶头滴管.
点评 本题考查了一定物质的量浓度溶液配制步骤及使用仪器,明确配制原理及容量瓶规格选择是解题关键,题目难度不大.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
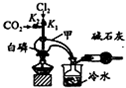 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

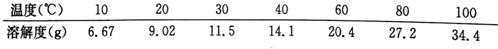
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1 NH4Cl溶液 | ||
| C. | 150 L 3 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1 CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入20 g 固体NaOH,搅拌、溶解 | |
| B. | 将溶液加热浓缩至0.2 L | |
| C. | 加入10 mol/L的NaOH溶液0.1 L,再稀释至1.5 L | |
| D. | 加入1 L 1.5 mol/L的NaOH溶液混合均匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L溶液中含阴、阳离子总数是0.6NA | |
| B. | 500mL溶液中Βa2+的浓度是0.2mol•L-1 | |
| C. | 500mL溶液中NO-3的浓度是0.4mol•L-1 | |
| D. | 1L溶液中含有0.2NA个NO-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基苯的实验室制备主要步骤如下:
硝基苯的实验室制备主要步骤如下: .
. +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com