
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害冷水系统的金属抑制剂。如图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有__。(写出两种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的氧化产物是__(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__。钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为__。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?__。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)“重结晶”过程的具体操作是:__。
【答案】①粉碎固体颗粒;②空气大大过量 MoO3、SO2 MoO3+Na2CO3=Na2MoO4+CO2↑ MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O PbS 当c(SO42-)=1.0×10-5mol/L,c(Ba2+)= 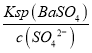 ==1.1×10-5mol/L,c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以会析出BaMoO4沉淀 “结晶”得到的粗品溶解得到溶液,蒸发浓缩,冷却结晶,过滤、洗涤、干燥
==1.1×10-5mol/L,c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以会析出BaMoO4沉淀 “结晶”得到的粗品溶解得到溶液,蒸发浓缩,冷却结晶,过滤、洗涤、干燥
【解析】
据题分析工艺流程图:钼精矿经焙烧转化为MoO3,再用Na2CO3溶液处理得到Na2MoO4,用沉淀剂将重金属沉淀,过滤后所得滤液经处理进行结晶、重结晶等过程最终获得产品。
(1)可采取将钼精矿粉碎或通入过量的空气提高焙烧效率;
答案为:①粉碎固体颗粒,②空气大大过量;
(2)MoS2中Mo和S的化合价分别为+4、-2,“焙烧”时MoS2转化为MoO3和SO2,Mo和S的化合价均升高,所以,该反应过程的氧化产物是MoO3和SO2;
答案为:MoO3、SO2;
(3)根据题意分析可知,“碱浸”时MoO3和Na2CO3反应生成Na2MoO4,所以,该化学方程式为:MoO3+Na2CO3=Na2MoO4+CO2↑;MoS2在碱性条件下,加入NaClO溶液,也生成钼酸钠,同时有SO42-生成,Mo和S被氧化,则Cl应被还原成Cl-,根据电子守恒、电荷守恒、质量守恒,可写出该反应的离子方程式:MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O;
答案为:MoO3+Na2CO3=Na2MoO4+CO2↑;MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O;
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则有反应:Pb2+ + S2- = PbS↓,所以废渣成分为PbS;
答案为:PbS;
(5)当c(SO42-)=1.0×10-5mol/L,c(Ba2+)=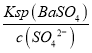 =
=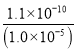 =1.1×10-5(mol/L),c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以会析出BaMoO4沉淀;
=1.1×10-5(mol/L),c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以会析出BaMoO4沉淀;
答案为:当c(SO42-)=1.0×10-5mol/L,c(Ba2+)=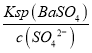 ==1.1×10-5mol/L,c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以会析出BaMoO4沉淀;
==1.1×10-5mol/L,c(Ba2+)×c(MoO42-)=1.1×10-5×0.40=4.4×10-6>4.0×10-8,所以会析出BaMoO4沉淀;
(6)“重结晶”过程的具体操作是:为除去“结晶”得到的粗品中的可溶性杂质,可将粗品溶解得到溶液,蒸发浓缩,冷却结晶,过滤、洗涤、干燥;
答案为:“结晶”得到的粗品溶解得到溶液,蒸发浓缩,冷却结晶,过滤、洗涤、干燥。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14g乙烯和丙烯的混合物完全燃烧时,产生的CO2分子数目为0.5NA
B.1L0.1mol/L的CH3COONa溶液中含有的CH3COO-数目为0.1NA
C.15.6g由Na2S和Na2O2组成的混合物中,含有的阴离子数目为0.2NA
D.标准状况下,16gO2和O3混合物中含有的氧原子数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、 (乙)、
(乙)、 (丙)的分子式均为C8H8,下列说法不正确的是
(丙)的分子式均为C8H8,下列说法不正确的是
A. 甲、乙、丙在空气口燃烧时均产生明亮并带有浓烟的火焰
B. 甲、乙、丙中只有甲的所有原子可能处于同一平面
C. 等量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲>乙
D. 甲、乙、丙的二氯代物数目最少的是丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶“的电化学实验装置如图所示,该装置能将H2O和CO2转化为 O2和燃料(C3H8O),下列说法不正确的是( )
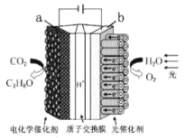
A.该装置工作时,H+从b极区向a极区迁移
B.a电极的反应为:3CO2+18H++18e-= C3H8O +5H2O
C.每生成1moO2, 有44g CO2被还原
D.C3H8O形成燃料电池以氢氧化钠溶液作为电解质溶液的负极反应式C3H8O-18H++24OH-=3CO32-+16H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Wilson病是一种先天性铜代谢障碍性疾病,D-青霉胺具有排铜作用,用以治疗或控制Wilson病症。D-青霉胺结构简式如图:
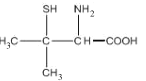
回答下列问题:
(1)写出Cu的简化电子排布式________。
(2)已知气态基态原子得到一个电子形成气态基态负一价离子所产生的能量变化称为该元素原子的第一电子亲合能(吸收能量为负值,释放能量为正值),试解释碳原子第一电子亲合能较大的原因 _________。 第一电子亲合能可能为正值或负值,而第二电子亲合能均为负值,原因是_____。
(3)D-青霉胺中,硫原子的VSEPR模型为____,碳原子的杂化方式为_______。
(4)请简述D-青霉胺能溶于水的主要原因________。
(5)青霉胺在临床治疗时对于症状改善较慢,常有并发症出现,因而近年采用锌剂(ZnSO4)替代治疗,可由硫化锌制备。立方硫化锌晶胞与金刚石晶胞类似,结构如图
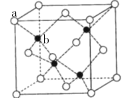
其中a代表S2-,b代表Zn2+。则该晶胞中S2-的配位数为______,若晶体的密度为ρg·cm-3,则晶胞的体积为________ cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1.12LCl2溶于2L水,溶液中含氯粒子的数目等于0.1NA
B.含有C-Si键数目为2NA的SiC晶体中硅原子的物质的量为1mol
C.14.0gFe发生吸氧腐蚀最终生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
D.室温下,0.05mol/L的硝酸铵溶液中氮原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是

A. b为正极,电极反应式为:O2+4H++4e-=2H2O
B. 电解质溶液中的H+移向a电极
C. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
D. 呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A.用 Na2CO3 溶液将水垢中的 CaSO4 转化为 CaCO3:CO3 2-+Ca2+ =CaCO3↓
B.电解饱和食盐水产生黄绿色气体:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
C.红热木炭遇浓硝酸产生红棕色气体:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
D.用新制 Cu(OH)2 检验乙醛,产生红色沉淀:CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中发生反应:![]() 。下列叙述中不能说明上述反应已达到化学平衡状态的是
。下列叙述中不能说明上述反应已达到化学平衡状态的是
A.混合气体的密度不变
B.体系的压强不变
C.混合气体的平均相对分子质量不变
D.反应体系中乙醇的物质的量浓度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com