
| A. | 石墨比金刚石稳定 | |
| B. | 等质量的石墨比金刚石能量高 | |
| C. | 发生了物理变化 | |
| D. | 金刚石转化为石墨没有化学键的断裂与生成 |
科目:高中化学 来源: 题型:选择题
| A. | HF溶液保存在玻璃试剂瓶中 | |
| B. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| C. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 硝酸应装在棕色瓶中密封避光保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | m+n<p+q△H>0 | B. | m+n>p+q△H>0 | C. | m+n<p+q△H<0 | D. | m+n>p+q△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaX的水溶液的碱性一定强于NaY水溶液的碱性 | |
| B. | HX一定是弱酸 | |
| C. | 反应结束时两者所用时间相同 | |
| D. | 浓度:C(HX)>C(HY) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
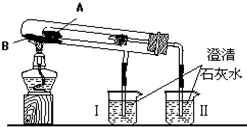
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
| 40 | 40.1 | 36.4 | 26.3 | 215 | |
| 80 | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO32-和Br-浓度都会减小 | B. | 溶液颜色会发生变化 | ||
| C. | 该过程中不会有沉淀生成 | D. | 离子浓度基本保持不变的只有Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com