


科目:高中化学 来源: 题型:
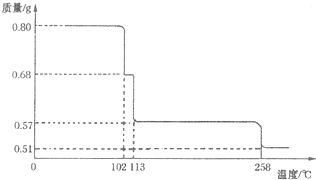 铜是一种与人类关系非常密切的有色金属.常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反应:2Cu=Cu2++Cu;大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH 等.
铜是一种与人类关系非常密切的有色金属.常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反应:2Cu=Cu2++Cu;大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH 等.查看答案和解析>>
科目:高中化学 来源: 题型:
 在Ni、NiO、Ni3C、γ-Al2O3组成的催化剂表面,可实现H2O、CO2及CH4合成乙醇.
在Ni、NiO、Ni3C、γ-Al2O3组成的催化剂表面,可实现H2O、CO2及CH4合成乙醇.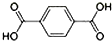 )、4,4’-联吡啶[
)、4,4’-联吡啶[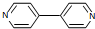 (可简化为
(可简化为 )]等与Ni2+能形成多核配合物.配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如下图:
)]等与Ni2+能形成多核配合物.配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如下图: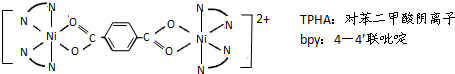
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
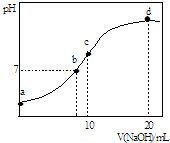 常温下,向20.00mL 0.1000mol?L-1 (NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.1000mol?L-1 (NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A、点a所示溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、点d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |
| D、点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、S是氧化剂,KOH是还原剂 |
| B、若3mol硫完全反应,则反应中共转移了4mol电子 |
| C、还原剂与氧化剂的质量比是1:2 |
| D、氧化产物和还原产物的物质的量之比为3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com