
����Ŀ��ʵ���ҳ����������ƹ����70%��Ũ�����Ʊ�SO2���壬��Ӧ����ʽΪNa2SO3+H2SO4=Na2SO4+SO2��+H2O�������һ��ʵ��װ�ã��ռ�һ�Թܸ����SO2���塣
��1�������淽���У�A��ʾ�ɷ�Һ©������ƿ��ɵ����巢���������ڴ���ϵ�A����ɸ÷�Ӧ��ʵ��װ��ʾ��ͼ(�г�װ�á����ӽ��ܲ��ػ�����β���������ֱ��뻭������Ҫ���ȵ������·��������)��������������ÿ�������·������ĸB��C����������ѡ�õ�����(��������)���ױ�ʾ���£�___

��2�����ݷ����е�װ��ͼ�ף��ڴ������д�±�(�ɲ�����)___
������� | �������������� | ���� |
A | �������ơ�Ũ���� | ����SO2 |
��3��ijʵ��С������ͼ��װ�òⶨ�ռ�����������SO2�ĺ�������Ӧ����װ�����Ը��������Һ��
��SO2�����Ը��������Һ������Ӧ�����ӷ���ʽΪ��___��
�ڷ�Ӧ������Һ�Ϻ�ɫ��ʧ����û�м�ʱֹͣͨ�������õ�SO2����___(ѡ���ƫ��������ƫ����������Ӱ����)
�������Ը��������Һ���ΪV1mL��Ũ��Ϊcmol/L�������������ӵ�ˮ�����ΪV2mL(������ɱ�״���µ����)����c��V1��V2��ʾSO2������ٷֺ���Ϊ___��
���𰸡�
������� | �������������� | ���� |
A | �������ơ�Ũ���� | ����SO2 |
B | Ũ���� | ��ȥˮ���� |
C | ||
D | ����������Һ | ���չ����Ķ�������ֹ������Ⱦ |
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ ƫ�� ![]() ��100%
��100%
��������
��1���Ʊ������һ��װ�ã�����װ�á�����װ�á��ռ�װ�ã��ݴ˽��
��2��������Ʋ�����Լ�ѡ��������������Ũ�����Ʊ�����������Ķ���������Ҫ��װ��A�м����������ƣ���Һ©���м���Ũ���ᣬ���������к���ˮ������ͨ��Ũ�����ȥˮ�������ڼ���ƿ���ռ�������������������������������Һ���ն��������ֹ��Ⱦ������
��3���ٸ���������������Ի����¾���ǿ�������ԣ��ܹ�������������������������ӣ�
�ڷ�Ӧ������Һ�Ϻ�ɫ��ʧʱ��SO2�뷴Ӧ���������ĸ����������ǡ�÷�Ӧ����û��ʱֹͣͨ������δ��Ӧ��SO2����Ҳ��ˮ�������ܣ�
�۸��ݷ�Ӧ��5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+��n��SO2��=2.5V1c��10-3mol������V=Vmn�����������������Ȼ������������İٷֺ�����
![]() �Ʊ������һ��װ�ã�����װ�á�����װ�á��ռ�װ�ã����ݷ�Ӧ����ʽ
�Ʊ������һ��װ�ã�����װ�á�����װ�á��ռ�װ�ã����ݷ�Ӧ����ʽ![]() ���Ʊ�����Ķ���������Ҫ��A�м����������ƹ��壬��Һ©���м���Ũ���ᣬ���ȷ�Ӧ���ɶ��������������к���ˮ��������Ҫͨ��Ũ�����ȥˮ�������ڼ���ƿ���������ſ������ռ��ռ���������Ķ����������������������Һ���չ����Ķ��������ֹ��Ⱦ�գ�װ����ͼ
���Ʊ�����Ķ���������Ҫ��A�м����������ƹ��壬��Һ©���м���Ũ���ᣬ���ȷ�Ӧ���ɶ��������������к���ˮ��������Ҫͨ��Ũ�����ȥˮ�������ڼ���ƿ���������ſ������ռ��ռ���������Ķ����������������������Һ���չ����Ķ��������ֹ��Ⱦ�գ�װ����ͼ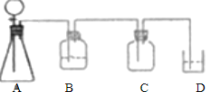 ��
��
![]() ������Ʋ�����Լ�ѡ��������������Ũ�����Ʊ�����������Ķ���������Ҫ��װ��A�м����������ƣ���Һ©���м���Ũ���ᣬ���������к���ˮ������ͨ��Ũ�����ȥˮ�������ڼ���ƿ���ռ�������������������������������Һ���ն��������ֹ��Ⱦ��������д����Ϊ��
������Ʋ�����Լ�ѡ��������������Ũ�����Ʊ�����������Ķ���������Ҫ��װ��A�м����������ƣ���Һ©���м���Ũ���ᣬ���������к���ˮ������ͨ��Ũ�����ȥˮ�������ڼ���ƿ���ռ�������������������������������Һ���ն��������ֹ��Ⱦ��������д����Ϊ��
������� | �������������� | ���� |
A | �������ơ�Ũ���� | ���� |
B | Ũ���� | ��ȥˮ���� |
C | ||
D | ����������Һ | ���չ����Ķ�������ֹ������Ⱦ |
![]() ����������������Ի����¾���ǿ�������ԣ��ܹ�������������������������ӣ���Ӧ�����ӷ���ʽ��
����������������Ի����¾���ǿ�������ԣ��ܹ�������������������������ӣ���Ӧ�����ӷ���ʽ��![]() ��
��
![]() ��Ӧ������Һ�Ϻ�ɫ��ʧ����û�м�ʱֹͣͨ�����ͻ�ʹ��
��Ӧ������Һ�Ϻ�ɫ��ʧ����û�м�ʱֹͣͨ�����ͻ�ʹ��![]() �������
�������![]() �������������ĺ���ƫ�ͣ�
�������������ĺ���ƫ�ͣ�
![]() ���ݷ�Ӧ��
���ݷ�Ӧ��![]() ��
��![]() �����������
�����������![]() ����
����![]() ������
������![]() ������ٷֺ���Ϊ
������ٷֺ���Ϊ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ϳɾ������½ṹ�����������ӣ������й�˵������ȷ����( )
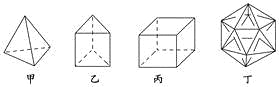
A. 1 mol�����ں���10 mol���ۼ�
B. ���ҷ��ӹ��ɵ����ʲ��ܷ���������Ӧ
C. �����ӵĶ���ȡ������ֻ������
D. ���Ӷ��Dz����ܺϳɵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Һ���й���������ȷ����
��� | �� | �� | �� | �� |
pH | 11 | 11 | 3 | 3 |
��Һ | ��ˮ | ����������Һ | ���� | ���� |
A. �ۢ��зֱ���������Ĵ����ƾ��������Һ��pH������
B. �ڢ�����Һ�������ϣ�������Һ��c(H��)��c(OH��)
C. �ֱ��ˮϡ��10����������Һ��pH�٣��ڣ��ܣ���
D. V1L����V2L����Һ��Ϻ�����Ϻ���ҺpH��7����V1��V2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2000��ŵ������ѧ��������λ������ѧ�Һ�һλ�ձ���ѧ�ң��Ա��������ڵ�����������Ĺ��ף��������ȰѾ���Ȳ��֬�Ƴɵ������ϡ����й��ھ���Ȳ������������ǣ� ��
A.����Ȳ������ȲΪ���巢���Ӿ۷�Ӧ�γɵĸ߾���
B.����Ȳ�Ļ�ѧʽΪ![]() ����������̼ԭ�Ӳ�������ͬһֱ����
����������̼ԭ�Ӳ�������ͬһֱ����
C.����Ȳ��һ��̼ԭ��֮���Ե�˫�������ϵ���״�ṹ������
D.����Ȳ��֬�����κ�����T�ɳ�Ϊ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������̼�ܵȲ��������Ķ��ε�ص�ԭ����ͼ��ʾ������˵����ȷ���ǣ� ��
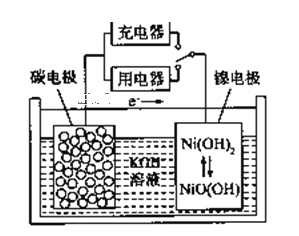
A. ���ʱ�������ĵ缫��ӦΪ��Ni(OH)2+OH-+e-=NiO(OH)+H2O
B. �ŵ�ʱ�������ĵ缫��ӦΪ��H2-2e-+2OH-=2H2O
C. �ŵ�ʱ��OH���������缫
D. ���ʱ������ص�̼�缫�����Դ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С������ͼװ���Ʊ���������Һ����̽�������ʡ�
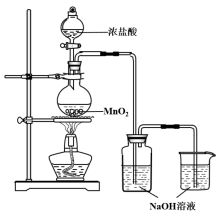
��Ӧֹͣ��ȡϴ��ƿ����ɫ��Һ5mL�ֱ����������ʵ�飺
���� | ���� |
a. ����ҺpH, �������еμ�2�η�̪ | pH = 13, ��Һ��죬5min����ɫ |
b. ��������μ������� | ��Һ��ɻ���ɫ |
��1��д����������װ���Ʊ�����Һ�漰��Ӧ�Ļ�ѧ����ʽ �� ��
��2���������ϣ���̪�ı�ɫ��ΧΪ8.2��10���ҷ�̪��ǿ������Һ�к�ɫ����ȥ
Ϊ̽������a����Һ��ɫ��ԭ���ֲ���������ʵ�飺
���� | ���� |
ȡ NaOH��Һ�������еμ�2�η�̪ | ��Һ��죬30min����ɫ |
��ý��ۣ���ʵ��С���Ʊ�������Һ���� �ԡ�
��3�� ��С���ɲ���b��ý��ۣ�������Һ���Ե���ǿ��������Һ���ȶ����½���
�� ����b����Һ��ɻ���ɫ��ԭ�� (�����ӷ���ʽ��ʾ)��
�� ��ͬѧ��Ϊ�ɲ���b����������۲����Ͻ�����Ҫ��һ��ȷ�ϴ˽��۵�ʵ�鷽���� ��
��4�� ��Ч�ȵĺ����Ǽ�⺬������������Ч������Ҫָ�ꡣ�����á���λ�����ĺ�������Һ�����������������ͷų����������������б�����һ���������Һ��Ч�Ⱥ�����5%���ϡ�С��ͬѧ��������ʵ��ⶨ��Ч�ȣ�ȡ������Һ5 g������20 mL 0.5 mol��L-1 KI��Һ��10 mL 2 mol��L-1��������Һ���Ӽ��ε�����Һ����0.1 mol��L-1 Na2S2O3��Һ�ζ����ɵ�I2����ζ��յ�ʱ����Na2S2O3 20 mL��(��֪��2S2O32- + I2 === S4O62- + 2I-) ��ע�����ԭ������Cl35.5��Na23��S32��O 16 ��I 127�� K39
�ٴﵽ�ζ��յ�ʱ��ʵ�������� ��
�ڴ�����Һ��Ч�Ⱥ���Ϊ %(����һλ��Ч����)����ý��ۣ���ʵ���Ƶõ�����Һ ������ϡ������ϡ�������Ҫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�����ڱ��IJ�ͼ������������ĸ���ŷֱ����ijһ��Ԫ�أ���ش�

(1)��������õĽ���������õķǽ����γɵ�������__________________(�ѧʽ)��
(2)��a��d����Ԫ�ؿ��γ����ֻ����д������һ�ֻ�����ֽ�������һ�ֻ�����Ļ�ѧ����ʽ��_____________________��
(3)e��f��k��m��Ӧ�ĵ�ԭ�����ӵİ뾶�ɴ�С��˳��Ϊ__________(�����ӷ���)��
(4)d��m��Ӧ�����ӻ�ԭ����ǿ����˳��Ϊ_________________________(�����ӷ���)��
(5)d��e��m����̬�⻯���У���ȶ�����________________________(�����ʽ)��
(6)�õ���ʽ��ʾn��m�γɵ�ԭ�Ӹ�����2��1�Ļ�������γɹ��̣�________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʹ�������Դ��չ����̼���á�������Ϊ��ѧ���о�����Ҫ���⡣�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�ء�
��1����֪����2CH3OH��l��+3O2��g����2CO2��g��+4H2O��g�� ��H1����1275.6kJmol-1
��2CO��g��+O2��g����2CO2��g�� ��H2����566.0kJmol-1
��H2O��g����H2O��l�� ��H3����44.0kJmol-1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��___��
��2����ҵ�ϼ״�����ˮú���ϳɣ���ӦΪCO(g)��2H2(g)=CH3OH(g) ��H<0����һ�������£���1molCO��2molH2ͨ���ܱ������н��з�Ӧ�����ı�ijһ�������(�¶Ȼ�ѹǿ)ʱ��CH3OH�����������(CH3OH)�仯������ͼ��ʾ��

��ƽ��ʱ��M��CH3OH���������Ϊ10%����CO��ת����Ϊ___��
��X����a�����ֵ��b��___(���С��)��
�������״���ԭ��CO��H2��Դ�ڣ�CH4��g��+H2O��g��CO��g��+3H2��g�� ��H��0��һ��������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ1����T1___T2���������������������������ͬ����A��B��C���㴦��Ӧƽ�ⳣ����KA��KB��KC���Ĵ�С��ϵΪ____��

��3������H2��O2��������Na2CO3��ɵ�ȼ�ϵ�أ����õ�ⷨ�Ʊ�N2O5��װ����ͼ2��ʾ������YΪCO2��

д��ʯī��缫�Ϸ�����Ӧ�ĵ缫��Ӧʽ___���ڵ���������N2O5�ĵ缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ��Ӧ![]() �ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ��
�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ��

A. ��Ӧ��c ��ﵽƽ��״̬
B. ��Ӧ��Ũ�ȣ�![]() ��С��
����![]() ��
��
C. ��Ӧ��������������������������
D. ![]() ʱ��SO2��ת���ʣ�
ʱ��SO2��ת���ʣ�![]() ��С��
����![]() ��
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com