
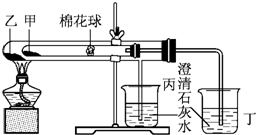
 ������ij��ȤС����ݿα�ʵ����Ƶ�һ����˵��̼������̼���������ȶ��Ե���ʵ�飮��۲���ͼ��ʵ��װ�ã�����ʵ��ԭ�����ش��������⣺
������ij��ȤС����ݿα�ʵ����Ƶ�һ����˵��̼������̼���������ȶ��Ե���ʵ�飮��۲���ͼ��ʵ��װ�ã�����ʵ��ԭ�����ش��������⣺���� ��1��̼�����Ʋ��ȶ��������ֽ⣬��̼�����ȶ��Խ�ǿ������ʱ���Էֽ⣬���ȴ��Թ�ʱ��̼���Ƶ������¶Ȼ����̼�����ƣ��ɸ����Ƿ���������ж��ȶ���ǿ����
��2����ˮ����ͭ����ˮ��ʾ��ɫ���ݴ˿��Լ����Ƿ���ˮ���ڣ�
��3�����ձ���װ��̼���Ƶ��Թ���������ʵ������в������ɶ�����̼��ʯ��ˮ�������ǣ�
��4�����ݼ�ΪС�մ���Ϊ������з�ӦNa2CO3+2HCl=2NaCl+H2O+CO2�������з�ӦNaHCO3+HCl=NaCl+H2O+CO2���жϣ�
��� �⣺��1��̼��������С�Թܣ�̼�����ڴ�ʹ�ܣ����Թ�ֱ�Ӽ��ȣ��ȶ��ϸߣ����¶ȽϸߵIJ��ֽ⣬�������¶Ƚϵ͵����ʷֽ⣬���ж��ȶ�ǿ�����ʼ�ΪС�մ���Ϊ����ʴ�Ϊ��̼�����ƣ�̼���ƣ�
��2����ɫ����ˮ����ͭ����ˮ��ʾ��ɫ����֤��̼�����������ܲ���ˮ������С�Թ�������մ����ˮ����ͭ��ĩ���������������˵����ˮ���ɣ��ʴ�Ϊ����ɫ��ĩ������
��3��̼���ƽ��ȶ������ȹ����в���ֽ⣬�����ӱ��ձ����Թܲ������������̼�����Զ��ձ��ij���ʯ��ˮ����ǣ��ʴ�Ϊ������ʯ��ˮ���������ǣ�����ʯ��ˮ����ǣ�
��4�����ݼ�ΪС�մ���Ϊ����ҷ�ӦNa2CO3+2HCl=2NaCl+H2O+CO2������ӦNaHCO3+HCl=NaCl+H2O+CO2�������������ᶼΪ2mol����̼�����ơ�̼���Ƶ�������Ϊ164��106=84��53���ʴ�Ϊ��84��53��
���� ���⿼��̼���ƺ�̼�����Ƶ�����̽������Ŀ�Ѷ��еȣ�ע�����̼���ơ�̼���������ʵIJ����ԣ����ݶ��ߵIJ�ͬ����ѡ����ȷ��ʵ�鷽����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�飺�����������գ�
ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�飺�����������գ�| ʵ���� | NaOH��Һ��Ũ�� ��mol/L�� | �ζ����ʱ��NaOH��Һ����������mL�� | ����������Һ����� ��mL�� |
| 1 | 0.10 | 22.50 | 20.00 |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
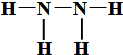
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ݷ�ɢϵ�Ƿ��ж����������ɢϵ��Ϊ���塢��Һ����Һ | |
| B�� | �����������ϴ���ڴ�Ź�FeCl3��Һ���Լ�ƿ | |
| C�� | ��������㷺�������������оƬ���ά | |
| D�� | ��⾫��ͭʱ���������к���Fe��Ag��Au�Ƚ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
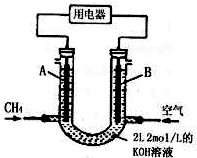 �縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ����������������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3������Fe��OH��3�������ԣ�������������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������ã�ij����С���õ縡ѡ���۷�������ˮ�����װ��ʾ��ͼ����ͼ��ʾ��
�縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ����������������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3������Fe��OH��3�������ԣ�������������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������ã�ij����С���õ縡ѡ���۷�������ˮ�����װ��ʾ��ͼ����ͼ��ʾ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com