
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
分析 (1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价;单质碘和氯酸钾的物质的量之比为6:11,6mol碘单质化合价升高了60价,则11mol氯酸钾化合价降低了60价;KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,设生成的氯气的物质的量为x、氯化钾的物质的量为y,则23x+y=11,10x+6y=60,据此计算出氯气、氯化钾的物质的量,配平反应的化学方程式;
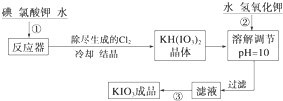
(2)KH(IO3)2在碱性条件下可以转化成KHIO3,根据物质的溶解度可以确定溶液获得晶体的方法;
(3)KIO3和KI在酸性条件下发生氧化还原反应生成I2,加入CCl4,碘可以被四氯化碳萃取,在酸性条件下,I-可被空气中的O2氧化成I2,碘遇淀粉显蓝色;
(4)设Ca(IO3)2•xH2O,根据题意:$\frac{390}{390+18x}$×100%=78.3%,x=6,根据电荷守恒和元素守恒可写出离子方程式,可以根据沉淀表面是否有氯离子判断沉淀是否已经洗涤干净;
解答 解:(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价;单质碘和氯酸钾的物质的量之比为6:11,6mol碘单质化合价升高了60价,则11mol氯酸钾化合价降低了60价;KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,设生成的氯气的物质的量为x、氯化钾的物质的量为y,则2x+y=11,10x+6y=60解得x=3、y=5,即反应产物氯气的化学计量数为3、氯化钾的计量数为5,所以反应的化学 方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,
故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)KH(IO3)2在碱性条件下可以转化成KHIO3,所以步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3,由于KIO3的溶解度受温度的影响较大且分解温度较高,所以采取蒸发结晶的方法,
故答案为:使KH(IO3)2转化为KIO3;蒸发结晶;
(3)KIO3和KI在酸性条件下发生氧化还原反应生成I2,加入CCl4,碘可以被四氯化碳萃取,所以下层呈紫红色,在酸性条件下,I-可被空气中的O2氧化成I2,所以当加入淀粉溶液时呈蓝色,反应的离子方程式为4I-+4H++O2═2I2+2H2O,
故答案为:液体分层,下层液体呈现紫红色;4I-+4H++O2═2I2+2H2O;
(4)设Ca(IO3)2•xH2O,根据题意:$\frac{390}{390+18x}$×100%=78.3%,x=6,根据电荷守恒和元素守恒可知,制备碘酸钙晶体的离子方程式为Ca2++2IO${\;}_{3}^{-}$+6H2O═Ca(IO3)2•6H2O,可以根据沉淀是否已经洗涤干净的方法是在最后一次洗涤液中加入硝酸银溶液,若无白色沉淀说明已经洗涤干净,
故答案为:Ca2++2IO${\;}_{3}^{-}$+6H2O═Ca(IO3)2•6H2O;在最后一次洗涤液中加入硝酸银溶液,若无白色沉淀说明已经洗涤干净.
点评 本题考查了离子反应方程式的书写以及实验基本操作,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,题目难度中等.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/LNH4Cl溶液加水稀释后,溶液中各微粒的浓度均减小 | |
| B. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| C. | 稀硫酸和稀氢氧化钠溶液加热上升一定温度后,前者pH不变后者pH减小(不考虑物质的挥发) | |
| D. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒压下充N2 | B. | 加B | C. | 恒容下充N2 | D. | 加A |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 丙炔腈(H-C=C-CN,沸点42.5℃)是一种星际分子,实验室可通过丙炔醇用铬酸酐氧化、盐酸羟胺肟化、再脱水来制备.
丙炔腈(H-C=C-CN,沸点42.5℃)是一种星际分子,实验室可通过丙炔醇用铬酸酐氧化、盐酸羟胺肟化、再脱水来制备.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com