
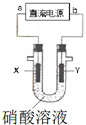
 某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极).电解过程中,X极产生了红棕色气体,则下列说法不合理的是( )
某兴趣小组为了分析电解硝酸溶液时放电的离子,设计了如图装置进行实验(石墨电极).电解过程中,X极产生了红棕色气体,则下列说法不合理的是( )| A. | a极为负极,b极为正极 | |
| B. | 电解时,Y极附近溶液pH降低 | |
| C. | 相同条件下,阴阳两极气体体积比是2:1 | |
| D. | X极的电极反应式是:2H++NO3-+e-═NO2↑+H2O |
分析 电解过程中,X极产生了红棕色气体,则X极上硝酸根离子得电子生成二氧化氮,所以X为阴极,则a为负极,b为正极,Y为阳极,阳极上氢氧根离子失电子生成氧气,结合电子守恒计算分析.
解答 解:电解过程中,X极产生了红棕色气体,则X极上硝酸根离子得电子生成二氧化氮,所以X为阴极,则a为负极,b为正极,Y为阳极,阳极上氢氧根离子失电子生成氧气,
A.由分析可知,a为负极,b为正极,故B正确;
B.Y为阳极,阳极上氢氧根离子失电子生成氧气,同时生成氢离子,所以Y极附近溶液pH降低,故B正确;
C.1molNO3-得到1mol电子1molNO2,2molH2O失去4mol电子生成1mol氧气,则阴阳两极气体体积比是4:1,故C错误;
D.X极上硝酸根离子得电子生成二氧化氮,X极的电极反应式是:2H++NO3-+e-═NO2↑+H2O,故D正确.
故选C.
点评 本题考查了电解原理,明确阴阳极上放电的物质或离子是解本题关键,注意根据阳极上发生失电子的氧化反应、阴极上发生得电子的还原反应判断电极反应物,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
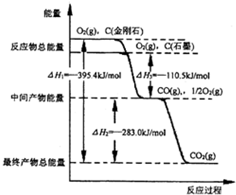 CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温 | B. | 加压 | ||
| C. | 恒温恒容通入氢气 | D. | 加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
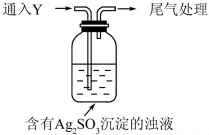 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
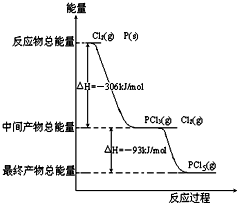 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质跟浓盐酸作用时呈黄色 | |
| B. | 聚乙烯塑料制品可用于食品的包装,而聚氯乙烯不能用于食品包装 | |
| C. | 木糖醇(C5H12O5)是一种甜味剂,与葡萄糖互为同系物 | |
| D. | 将一小块钠加入乙醇中,钠浮于乙醇上,缓慢反应生成氢气,说明乙醇中羟基上的氢原子相对于水不活泼 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com