
分析 某一卤代烃不能使卤素的水溶液褪色,说明不含有不饱和键,取$\frac{1}{10}$体积的该溶液向其中滴0.2mol/L的AgNO3溶液出现浅黄色沉淀,沉淀为AgBr,说明含有设某一卤代烃为RBr,由关系式:RBr~AgNO3解得.
解答 解:某一卤代烃不能使卤素的水溶液褪色,说明不含有不饱和键,取$\frac{1}{10}$体积的该溶液向其中滴0.2mol/L的AgNO3溶液出现浅黄色沉淀,沉淀为AgBr,说明含有设某一卤代烃为RBr,
RBr~AgNO3
1 1
$\frac{6.15}{M+80}$×$\frac{1}{10}$ 0.2mol/L×0.025L
解得:M=43,则烃基为-C3H7,分子式C3H7Br,结构简式为CH3CH2CH2Br;CH3CHBrCH3;
故答案为:C3H7Br;CH3CH2CH2Br;CH3CHBrCH3.
点评 本题考查有机物分子式的确定、同分异构体书写等,难度中等,根据一卤代烷与氢氧化钠溶液共热生成的卤离子与硝酸银反应生成沉淀,根据沉淀的质量即可计算出一卤代烷的式量,难度中等.


科目:高中化学 来源: 题型:解答题
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.| 时间/min | 0 | 1 | 3 | 8 | 11 |
| n(H2)mol | 8 | 6 | 3 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
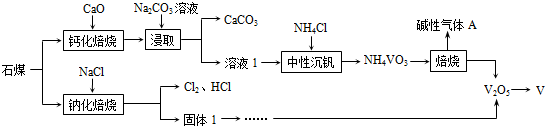
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
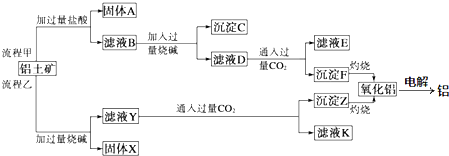
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间里每增加1molN2,同时减少2molNH3 | |
| B. | c(N2):c(H2):c(NH3)=1:1:1 | |
| C. | N2与H2的物质的量与NH3的物质的量相等 | |
| D. | N2、H2和NH3的质量分数不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
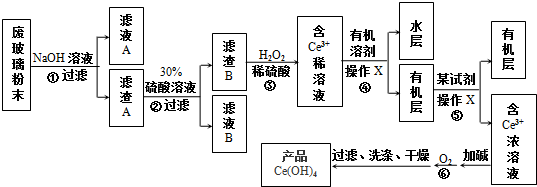
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com