
| A、100mL 0.5mol?L-1MgCl2溶液 |
| B、200mL 1mol?L-1CaCl2溶液 |
| C、50mL 1mol?L-1NaCl溶液 |
| D、25mL 0.5mol?L-1HCl溶液 |


科目:高中化学 来源: 题型:
| A、金属单质与盐溶液的反应都是置换反应 |
| B、4Fe(OH)2+O2+2H2O═4Fe(OH)3属于化合反应 |
| C、SO2+Cl2+2H2O═2HCl+H2SO4属于氧化还原反应 |
| D、反应AgNO3+HCl═AgCl↓+HNO3不能说明盐酸酸性比硝酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定有K2CO3 |
| B、肯定有Ba(NO3)2 |
| C、肯定有Na2SO4 |
| D、肯定有CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是国际单位制中的一个基本物理量 |
| B、萃取操作时,可以选择有机萃取剂,且萃取剂的密度必须比水大 |
| C、当光束分别通过氢氧化铁胶体、氯化铁溶液时,都可以从侧面看见光亮的通路 |
| D、根据分散质粒子的直径大小,分散系可分为溶液、胶体和浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
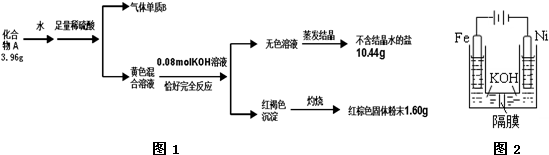
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCO3 |
| B、Na2SO4 |
| C、CuSO4 |
| D、Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 相关信息 | |
| X | X原子基态时最外层电子数是其内层电子数的2倍 |
| Y | Y原子基态时2p原子轨道上有3个未成对电子 |
| Z | Z的基态原子最外层电子排布式为:nsnnpn+2 |
| W | W的原子序数为24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com