
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,Z分别与X,Y形成B、C两种电子数均等于10的分子 且一个B分子中含有的Z原子个数比C分子中少1个 请回答下列问题:
(1)Y元素在周期表中的位置是 周期 族。
(2)B的电子式是 ,B与C反应的化学方程式为 。
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.所有不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
查看答案和解析>>
科目:高中化学 来源: 题型:
 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应: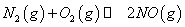 ,是导致汽车尾气中含有NO的原因之一。
,是导致汽车尾气中含有NO的原因之一。
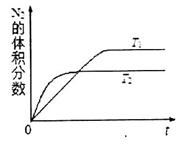
①在 温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应
温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应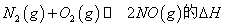 __________0(填“>”或“<”)。
__________0(填“>”或“<”)。
②在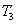 温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率
温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率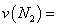 ___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
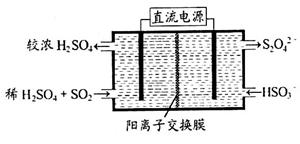 (2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
(2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有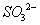 生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L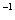 的醋酸与b mol
的醋酸与b mol L
L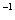
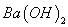 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在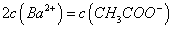 ,则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
,则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有50 mL澄清饱和石灰水的小烧杯中放入一小块钠,不可能观察到的现象是
 A.钠熔化成银白色小球 B.在液面快速游动
A.钠熔化成银白色小球 B.在液面快速游动
























 C.溶液底部出现光亮的银白色固体 D.溶液变浑浊
C.溶液底部出现光亮的银白色固体 D.溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为2:5的锌与稀硝酸恰好完全反应,若硝酸被还原的产物为N2O,
反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A. 1:4 B.1:5 C. 2:3 D.2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
第119号未知元素,有人称为“类钫”。根据周期表结构及元素性质变化趋势,有关“类钫”的预测的说法错误的是
A.单质有较高的熔点 B.“类钫”在化合物中呈+1价
C.“类钫”具有放射性 D.“类钫”单质的密度小于1g.cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
实 验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知:SO3熔点为
验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知:SO3熔点为
16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。
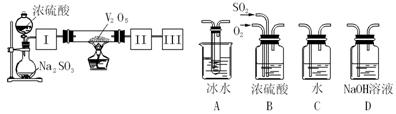
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15 kJ热量,此反应的热化学方程式为 ;
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,并将其字母填入空格中:装置Ⅰ ,装置Ⅱ ;
(3)开始进行实验时,首先应进行的操作是 ;
(4)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3尽可能被充分吸收,操作方法是 ;
(5)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是: ×100%(用含字母的最简代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—化学与技术】
I.目前,我国采用“接触法”制硫酸,设备如图所示:
 (1)图中设备A的名称是_____________ ,该设备中主要反应的化学方程式为 。
(1)图中设备A的名称是_____________ ,该设备中主要反应的化学方程式为 。
(2)有关接触法制硫酸的下列说法中,不正确的是_______(填字
母序号)。
A.二氧化硫的接触氧化在接触室中发生
B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为 H2SO4时放出的热量
II. 纯碱是一种重要的化工原料。制碱工业主要有“氨碱法”(索尔维法)和“联合制碱法”(侯氏制碱法)两种工艺。请按要求回答问题:
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于 ,“氨碱法”中CO2来源
于 。
(4)氨碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比) 。
(5)写出“联合制碱法”有关反应的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com