
| A. | CO2 | B. | H2O | C. | NaOH | D. | H2SO4 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA、IIA族元素和第VIA、VIIA族元素之间易形成离子键,离子化合物中含有离子键,可能含有共价键,部分碱、盐及金属氧化物都属于离子化合物,以此解答该题.
解答 解:A.二氧化碳中碳原子和氧原子之间存在共价键,为共价化合物,故A错误;
B.水中H和O原子之间存在共价键,为共价化合物,故B错误;
C.氢氧化钠由钠离子和氢氧根离子构成,为离子化合物,故C正确;
D.硫酸只含有共价键,为共价化合物,故D错误.
故选C.
点评 本题考查了离子键、共价键、化合物、单质等基本概念,为高频考点,侧重于学生的分析能力的考查,熟悉这几个概念的内涵是解本题关键,根据物质中含有的化学键判断物质类型,难度不大.


科目:高中化学 来源: 题型:解答题
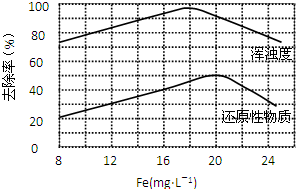 FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
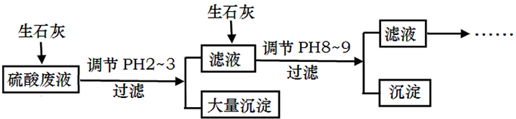
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
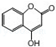 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: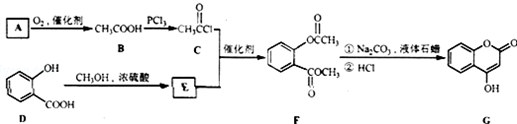
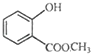 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该有机物分子中碳、氢、氧原子个数比为1:2:3 | |
| B. | 该有机物分子中碳、氢原子个数比为1:2 | |
| C. | 该有机物中必含氧元素 | |
| D. | 该有机物中可能不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
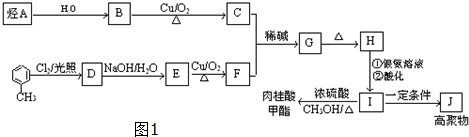
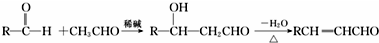
 $→_{△}^{硫酸}$
$→_{△}^{硫酸}$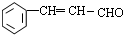 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸发食盐水时,边加热边用玻璃棒搅拌直至液体蒸干 | |
| B. | 鉴别Na2CO3与NaHCO3固体可用加热的方法 | |
| C. | 实验室制备氢氧化铁胶体时,向饱和氯化铁溶液中滴加氢氧化钠溶液 | |
| D. | 配制一定物质的量浓度的NaOH溶液,将NaOH固体放在容量瓶中加水溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com