
【题目】将含有0.1molSiO2的铝、硅混合物分别与足量NaOH溶液、盐酸混合,充分反应后前者可得到11.2L气体(标准状况),后者可得到6.72L气体(标准状况),则参加反应的n(HCl)与n(NaOH)之比为( )
A.1:1
B.1:2
C.2:1
D.3:1
【答案】A
【解析】解:混合物与足量NaOH溶液反应生成氢气的物质的量为 ![]() =0.5 mol,混合物与足量盐酸反应生成氢气的物质的量为
=0.5 mol,混合物与足量盐酸反应生成氢气的物质的量为 ![]() =0.3 mol,而混合物中只有铝能与盐酸反应,由此可求出n(Al)=0.2 mol,硅、铝均能与NaOH溶液反应且铝与NaOH溶液反应放出的氢气也是0.3 mol,故Al与NaOH溶液反应放出的氢气是0.2 mol,由此可求出n(Si)=0.1 mol.铝完全反应消耗0.6 mol HCl,0.1molSiO2需要0.2mol的NaOH、0.2 mol铝需要0.2mol的NaOH、硅0.1 mol需要0.2mol的NaOH,所以混合物共需0.6mol的氢氧化钠,所以参加反应的n(HCl)与n(NaOH)之比为1:1,故选:A.
=0.3 mol,而混合物中只有铝能与盐酸反应,由此可求出n(Al)=0.2 mol,硅、铝均能与NaOH溶液反应且铝与NaOH溶液反应放出的氢气也是0.3 mol,故Al与NaOH溶液反应放出的氢气是0.2 mol,由此可求出n(Si)=0.1 mol.铝完全反应消耗0.6 mol HCl,0.1molSiO2需要0.2mol的NaOH、0.2 mol铝需要0.2mol的NaOH、硅0.1 mol需要0.2mol的NaOH,所以混合物共需0.6mol的氢氧化钠,所以参加反应的n(HCl)与n(NaOH)之比为1:1,故选:A.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌.某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: 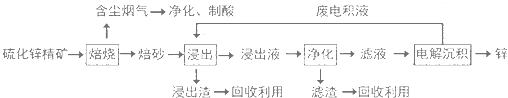
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为 .
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的操作.
(3)浸出液“净化”过程中加入的主要物质为 , 其作用是 .
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb﹣Ag合金惰性电极,阳极逸出的气体是 .
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质.“氧压酸浸”中发生的主要反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:Al2O3+N2+3C ![]() 2AlN+3CO,下列有关该反应叙述正确的是( )
2AlN+3CO,下列有关该反应叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.AlN的摩尔质量为41 g
C.AlN中氮元素的化合价为+3
D.上述反应中,每生成1 mol AlN需转移3 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气、液氯、新制氯水和久置氯水的比较正确的是 ( )
A. 氯气、液氯、新制氯水和久置氯水中均含氯元素的单质
B. 氯气和久置氯水无漂白性,而液氯和新制氯水有漂白性
C. 久置氯水中无HClO,其他成分与新制氯水相同
D. 新制氯水和久置氯水均具对酸性,且后者酸性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芒硝化学式为Na2SO410H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
①该电解槽的阳极反应式为 . 此时通过阴离子交换膜的离子数(填“>”、“<”或“=”)通过阳离子交换膜的离子数.
②制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)导出.
③通电开始后阴极附近溶液pH会(填“增大”、“减小”或“不变”).
④若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池.已知H2的燃烧热为285.8kJmol﹣1则该燃料电池工作产生36g H2O时理论上有kJ的能量转化为电能.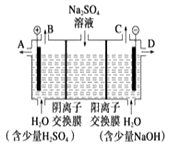
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的△H表示可燃物燃烧热的是( )
A.2H2(g)+O2(g)=2H2O(l)△H1
B.C(s)+ ![]() O2(g)=CO(g)△H2
O2(g)=CO(g)△H2
C.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O( l )△H3
D.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O( l )△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列有机化合物的结构简式,完成下列填空。
①CH3CH2CH2C(CH3)3
②HCOOCH2CH3
③CH3CHClCH2CH3
④CH3CHClCH===CHCH3
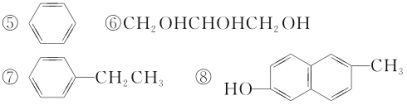
⑨(CH3)2CHCOOH ⑩CH3CHO
对以上有机化合物进行分类,其中:
(1)含有羟基(—OH)的是____________。
(2)含有羟基但不属于醇的是____________。
(3)属于烯烃的是____________。
(4)属于芳香烃的是____________。
(5)属于羧酸的是____________。
(6)属于醛的是____________。
(7)属于卤代烃的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol NaHCO3 和一定量的Na2O2固体混合,在加热的条件下使其充分反应,经测定无Na2O2剩余,则最后所得固体的物质的量为( )
A.1 mol﹣2 mol之间
B.1mol﹣4mol之间
C.2 mol﹣4 mol之间
D.大于4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com